Азот утворює ряд оксидів, формально відповідають усім можливим ступенів окислення від +1 до +5: N2 O, NО, N2 O3. NO2. N2 O5. проте всього два з них - оксид азоту (II) і оксид азоту (IV) - не тільки стійкі при звичайних умовах, але і активно задіяні в природному і промисловому круговоротах азоту.
1.2.1 Деякі сполуки азоту та їх властивості
оксиди азоту
N2 + 1 O - оксид азоту (I), закис азоту, «звеселяючий» газ, несолеобразующіе оксид. Отримують N2 O розкладанням аміачної селітри:
N2 O має слабкий приємний запах і солодкуватий смак. З киснем, водою, розчинами кислот і лугів не реагує. Розкладається на елементи при температурі вище 500 ° С, іншими словами, досить стійкий.
Будова: у кисню 2 неспарених електрона, у азоту 3 - утворюється подвійний зв'язок і один неспарених електронів в залишку. Можна припустити, що молекули NO будуть спаровуватися і утворювати димерную молекулу ONNO. Будова молекули: лінійна молекула О = N = N, в якій центральний атом N чотиривалентний. Він утворює дві подвійні зв'язку: одну - з киснем за типовою схемою створення ковалентного зв'язку (два електрона азоту, два електрона кисню), іншу - з атомом азоту (який два зі своїх трьох неспарених електронів спаривает і утворює за рахунок цього порожню орбіталь), одна з зв'язків ковалентний, друга донорно-акцепторні (рис. 1). Установка для отримання оксиду азоту (I) складається з штативів, пробірки, пробки з газовідвідною трубкою, кристалізатора, циліндра і спиртівки (рис. 2). У пробірку поміщають NH4 NO3. закривають пробкою з газовідвідною трубкою і нагрівають. Газ збирають в циліндр, наповнений водою.
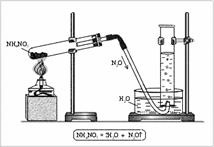

Мал. 2. Одержання оксиду азоту (I) в лабораторії
Оксид N2 O розкладається при нагріванні:
Оксид N2 O реагує з воднем:
N +2 O - оксид азоту (II). несолеобразующіе оксид. Отримують NO реакцією міді з кислотою HNO3 (разб.) (Рис. 3).
Кристалічна решітка молекулярна; молекула легка, слабополярная (електронний торгівельний кисню трохи вище, ніж у азоту). Можна припустити, що температури плавлення і кипіння будуть низькими, але вище, ніж у азоту, т. К. Полярність молекули дає можливість підключати електростатичні сили тяжіння до просто міжмолекулярним силам. Освіта димера теж сприяє підвищенню температури кипіння. Будова молекули дозволяє припустити і невисоку розчинність в воді. Оксид азоту (II) не має ні кольору, ні запаху.
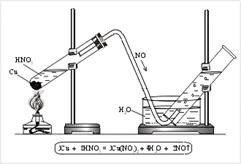

Мал. 3. Одержання оксиду азоту (II) в лабораторії
Для отримання оксиду азоту (II) в пробірку поміщають трохи мідних стружок і заливають розбавлену азотну кислоту. Пробірку закривають пробкою з газовідвідною трубкою і зміцнюють в штативі. Кінець газовідвідної трубки опускають в кристалізатор з водою і далі в циліндр (рис. 3). При нагріванні виділяється NO. NO легко окислюється киснем повітря, т. Е. Діє як відновник:
В реакції з сірчистим газом оксид NO - окислювач:
N + 22O3 - оксид азоту (III). азотистий ангідрид (йому відповідають азотистая кислота HNО2 і солі нітрити); це кислотний оксид, для нього характерні всі властивості кислотних оксидів. Отримують оксид N2 O3 по реакції:
Розглянемо електрони азоту в молекулі NО. Це неспарених електронів, вільна пара електронів і ще два електрона на зв'язку з киснем - всього п'ять. А у атома кисню, «що виходить на зв'язок», шість електронів на чотирьох орбіталях. Якщо розташувати їх по два, то одна орбіталь залишиться вільною. Саме її і займає пара електронів атома азоту (рис. 4, 5).
Мал. 4. Схема електронної будови молекули NO2 (перший варіант). (Точками позначені електрони атомів О, хрестиками - електрони атома N)
Мал. 5. Схема електронної будови молекули NO2 (другий варіант). (Зірочкою позначений збуджений атом O, стрілкою - донорно-акцепторні зв'язок.
Раз пара електронів, що знаходиться на s-орбіталі, «пішла на зв'язок», вона просто зобов'язана піддатися гібридизації. Виникає питання: який тип гібридизації використовує атом? Відповідь: три електронні орбіталі азоту знаходяться в стані sp 2-гібридизації. Молекула NO2 кутова, кут 134 ° (кут більше 120 ° тому, що 1 електрон відштовхує від себе електрони зв'язку слабкіше, ніж пара електронів) (рис. 6, 7).
Кристалічна решітка молекулярна, однак, оскільки сама молекула важче NO і схильність до димеризации у неї помітно вище, то плавитися і кипіти ця речовина має при помітно більш високих температурах. Температура кипіння становить 21 ° С, тому при звичайних умовах - 20 ° С і 760 мм рт. ст. - оксид азоту (IV) рідкий.
Оксид азоту (IV) у воді розчиняється, одночасно з нею реагуючи, і виходить при цьому відразу дві кислоти.
Мал. 7. Молекула NO2- вид «збоку», з боку донорно-акцепторного зв'язку. (Другий атом кисню не видний за орбиталями атома азоту. Заштриховані гуртки - це гібрідізоваться орбіталі атомів, спрямовані до читача.)
Оксид азоту (IV) має і характерний різкий запах, і рудувато-бурий колір, відтінки якого відрізняються один від одного в залежності від концентрації. Саме за цей колір викиди оксидів азоту в атмосферу називають «лісьімі хвостами» [4].
3) Димеризація при охолодженні:
При температурі -11 ° С рівновагу повністю зміщений вправо, а при 140 ° С - цілком вліво.
1.2.1.2 Азотна кислота
З гідроксидів азоту ми розглянемо найбільш великотоннажний - азотну кислоту.
Молекула азотної кислоти полярна (через різну електронегативності кисню і водню, тому що азот як би прихований всередині молекули) і асиметрична. Всі три наявних в ній кута між зв'язками азоту з киснем різні. Формальна ступінь окислення азоту вища (+5). Але при цьому тільки 4 зв'язку у атома азоту з іншими атомами - валентність азоту дорівнює 4.
Будова молекули легше зрозуміти, якщо розглянути процес її отримання. Азотна кислота виходить при реакції оксиду азоту (IV) з водою (в присутності кисню): дві молекули NO2 одночасно «атакують» молекулу води своїми неспареними електронами, в результаті зв'язок водню з киснем розривається не як зазвичай (пара електронів у кисню і «голий протон »), а одній молекулі NO2 дістається водень зі своїм електроном, інший - радикал ОН (рис. 8). Утворюються дві кислоти: обидві кислоти сильні, обидві швидко віддають свій протон найближчим молекулам води і залишаються в результаті у вигляді іонів NO2 - і NO3 -. Іон NO2 - нестійкий, дві молекули НNО2 розкладаються на воду, NО2 і NО. Оксид NO реагує з киснем, перетворюючись в NО2. і так до тих пір, поки не вийде одна тільки азотна кислота.
Мал. 8. Схема освіти молекул азотної і азотистої кислот. (Чорна куля - атом N, великі білі кулі - атоми O, маленькі білі кульки - атоми H.)
Формально виходить, що з одним атомом кисню атом азоту пов'язаний подвійним зв'язком, а з іншим - звичайної одинарної зв'язком (цей атом кисню пов'язаний ще і з атомом водню). З третім атомом кисню азот в HNO3 пов'язаний донорно-акцепторної зв'язком, причому в якості донора виступає атом азоту. Гібридизація атома азоту при цьому повинна бути sр 2 через наявність подвійного зв'язку, що визначає структуру - плоский трикутник. Реально виходить, що дійсно фрагмент з атома азоту і трьох атомів кисню - плоский трикутник, тільки в молекулі азотної кислоти цей трикутник неправильний - все три кути ОNО різні, отже, і різні сторони трикутника. Коли ж молекула дисоціює, трикутник стає правильним, рівностороннім. Значить, і атоми кисню в ньому стають рівноцінними. Однаковими стають і всі зв'язки.
Фізичні властивості азотної кислоти
З'єднання іонізоване, нехай навіть і частково, складно перевести в газ. Таким чином, температура кипіння повинна б бути досить високою, проте при такій невеликій молекулярній масі температура плавлення високої бути не повинна. Отже, агрегатний стан при 20 ° С рідке. Що стосується розчинності, то, як і багато інших полярні рідини, азотна кислота легко змішується з водою в будь-яких співвідношеннях. Чиста азотна кислота безбарвна і не має запаху. Однак через розкладання на кисень і оксид азоту (IV), який в ній же і розчиняється, можна сказати, що звичайна концентрована азотна кислота має жовто-бурий колір і характерний для NO2 різкий запах. Подивимося, як впливає будова молекули азотної кислоти на її хімічні властивості.
НNО3 - Сильний окислювач
При взаємодії НNО3 з металами (М) водень не виділяється:
М + НNО3 сіль + вода + газ.
Суміш HNO3 (конц.) З HCl (конц.) В об'ємному співвідношенні 1: 3 (1V HNO3 + 3V HCl) називають «царською горілкою».
Азотна кислота не реагує з іншими кислотами за типом реакцій обміну або з'єднання. Однак цілком здатна реагувати як сильний окислювач. В суміші концентрованих азотної і соляної кислот протікають оборотні реакції, суть яких можна узагальнити рівнянням:
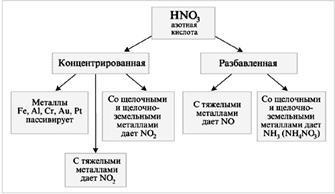

Утворений атомарний хлор дуже активний і легко відбирає електрони в атомів металів, а хлорид-іон утворює стійкі комплексні іони з зображеннями, що виходять іонами металів. Все це дозволяє перевести в розчин навіть золото. Концентрована H2 SO4 як сильне водоотнимающее засіб сприяє реакції розкладання азотної кислоти на оксид азоту (IV) і кисень. Азотна кислота - одна із сильних неорганічних кислот і, природно, з лугами реагує. Реагує вона також і з нерозчинними гідроксидами, і з основними оксидами [4].
При вивченні теми «Азот. Сполуки азоту »користуються підручником хімії під редакцією Г.Є. Рудзитис, Ф.Г. Фельдман, також підручником за 9 клас під редакцією Н.С. Ахметова. Дидактичним матеріалом служить книга з хімії для 8-9 класів під редакцією А. М. Радецького, В. П. Горшкова; використовуються завдання для самостійної роботи з хімії за 9 клас під редакцією Р.П. Суровцева, С.В. Софронова; використовується збірник задач з хімії для середньої школи і для вступників до вузів під редакцією Г.П. Хомченко, І.Г. Хомченко. На вивчення цієї теми відводиться 7 год [3, 5].
Перейти до завантаження файлу