Як вірус проникає в клітину
Юрій Олександрович Чізмаджев, чл.-кор. РАН, д. Х. н. проф. кафедри біофізики МГУ,
завідувач лабораторією біоелектрохіміі Інституту електрохімії ім.А.Н.Фрумкіна РАН.
Як відомо, клітина містить величезну кількість мембранних утворень - від ізольованих везикул до безперервної мережі ЕПР. І вся ця система знаходиться в стані постійної перебудови, яка включає множинні акти злиття і поділу. Так, в апараті Гольджі білок упаковується в контейнери-везикули, які зливаються з мембраною. Це завершує процес екзоцитозу. Інший приклад - злиття синаптичної мембрани і секреторних пухирців з нейромедиаторами, в результаті чого і відбувається передача нервового імпульсу, одного з основних переносників інформації.
Доставка великих частинок всередину клітини здійснюється за допомогою ендоцитозу. Клітка заковтує частки із зовнішнього середовища, які обволікаються ділянкою плазматичноїмембрани, утворюється западина, перемичка руйнується, і контейнер виявляється всередині клітини. Його розбирання - це вже інша історія, а нам залишається підкреслити, що і ендоцитоз, і екзоцитоз опосередковані безліччю білків, чиї природа і механізм дії не цілком встановлено.
Крім "корисного" злиття клітка часто-густо переживає випадки злиття "шкідливого". Наприклад, коли її атакує вірус, з яким досить сказати: "Сезам, відкрийся!", І ліпідна оболонка вірусу зливається з мембраною. При цьому формується так звана пора злиття, і вірусна ДНК або РНК починають господарювати всередині клітини. Справедливості заради треба відзначити, що унікальну здатність вірусів "розкривати сейфи" вже використовують на благо організму. У генної терапії підбирають нешкідливі віруси-зломщики, до яких пришивають корисний ген, здатний допомогти хворій клітці.
Розібратися в фізичному механізмі злиття біологічних об'єктів надзвичайно важко. Як завжди, в подібних випадках на допомогу приходять модельні системи. Звертаючись в недавнє минуле, слід підкреслити, що в середині 80-х були досягнуті вражаючі успіхи у вивченні механізму злиття ліпідних бішару [1]. Однак до середини 90-х з'ясувалося: інтермедіати цього процесу, прийняті в теоретичних моделях, мають настільки високу енергію, що його розрахункова швидкість, всупереч експериментальними даними, мізерно мала. Крім того, хоча було доведено, що спеціальні білки відіграють ключову роль в ході злиття, залишалося неясним, що ж вони роблять. Вирішенню цих завдань були присвячені експериментальні і теоретичні роботи нашої лабораторії, які проводилися в другій половині 90-х.
Шлях вірусу в клітину
Світ вірусів дуже різноманітний. Загальна для них те, що будь-який спадковий матеріал (у формі ДНК або РНК) дбайливо упакований в захисний скафандр з білків. Вірусні частинки (віріони) відрізняються за формою і розмірами. Так, діаметр сферичних віріонів - від 20 до 300 нм. Деякі віруси мають додаткову липидную оболонку, в яку включені спеціалізовані білки, які сприяють злиттю мембран. Такі віруси називаються оболонкових. Вимоги до липидно-білковій оболонці двоїсті. З одного боку, вона повинна вберегти спадковий матеріал від примх долі, а з іншого - легко руйнуватися, коли вірус починає активне життя всередині клітини-жертви.
Оболонкові віруси проникають в клітку двома шляхами. У першому випадку вірус зв'язується з рецепторами клітинної поверхні, потім в результаті ендоцитозу, везикули, що містять віріон, відокремлюються. В такому стані вірус упакований в додаткову оболонку, утворену клітинної мембраною. Від другої оболонки він звільняється при злитті везикули з ендосомамі, в якій кисле середовище активує білки злиття і тим самим сприяє об'єднанню мембрани віріона з ендосомальной. В результаті спадковий матеріал потрапляє в цитоплазму і може дістатися до ядра. На перших стадіях цього процесу, включаючи проникнення в ендосом, вірус грає пасивну роль. Тут використовується звичайний механізм ендоцитозу, причому довірлива клітина навіть не знає, яку небезпеку таїть у собі цей "подарунок долі". І тільки опинившись в ендосомамі, вірус активується і бере всю гру на себе, викликаючи злиття своєї оболонки з ендосомальной мембраною. Саме так діє всім відомий вірус грипу.
Два шляхи проникнення оболочечного вірусу в клітину.
Зліва - ендоцитоз і злиття в ендосомамі: 1 - вірус, 2 - ендосомамі, 3 - ядро.
Праворуч - злиття з мембраною.
Інші віруси, наприклад вірус імунодефіциту людини (HIV), не потребують для активації в низьких рН і проникають в клітку простішим шляхом, в ході якого їх оболонки відразу зливаються з мембраною, і спадковий матеріал виявляється до клітки. Тепер йому залишається тільки дістатися до ядра.
Таким чином, в будь-якому випадку ключова подія в битві оболочечного вірусу з клітиною - злиття його ліпідної оболонки з плазматичної або лізосомальної мембраною. Саме цій найважливішій стадії інфікування клітини і присвячений наш розповідь. Конкретно мова піде про вірус грипу А. Завдяки особливостям своєї будови він виявився найбільш зручним об'єктом для експериментального вивчення механізму злиття.
Цей оболончатий вірус має приблизно сферичну форму з діаметром близько 0.13 мкм. У його центральній частині знаходяться молекули РНК і ряд білків, необхідних вірусу на перших стадіях життя в клітці. Серцевина віріона оточена оболонкою з білка М1, слідом за нею розташовується ліпідна мембрана. Білкова оболонка, втоплена в ліпідної мембрані, нагадує рибальську мережу, яка кріпиться на палях. Розмір осередків в білкової мережі приблизно 4 ґ 4 нм 2. так що така велика "риба", як комплекс РНК-білок, пройти крізь них не може. Ліпідна оболонка формується з плазматичної мембрани інфікованої клітини при отпочковиванія синтезованого вірусу. У цій мембрані заякорити три білка: нейрамінідаза (Н), іонний канал М2 і гемаглютинін (ГА). При закислення середовища завдяки іонного каналу всередині віріона знижується рН, що призводить до руйнування білкової оболонки М1. Одночасно активується гемаглютинін, головна складова "машини злиття". В ході її роботи мембрани вірусу і клітини змикаються, і в цитоплазму відкривається шлях для чужорідного генетичного матеріалу.
Схема віріона грипу:
ГА - гемаглютинін, М2 - іонний канал, Н - нейрамінідази, М1 - білкова оболонка.
На поверхні вірусної оболонки гемаглютинін присутній у вигляді тримерів. Кожна його молекула складається з двох субодиниць: ГА1, що забезпечує первинний контакт з клітиною-мішенню, і ГА2, що відповідає за злиття. У вихідному, нейтральному, стані (при рН7) все тримери орієнтовані приблизно перпендикулярно до поверхні мембрани, їх протяжність
13 нм. Кожна молекула гемаглютиніну міцно заякорена в своїй мембрані і, що дуже важливо, має в своєму складі короткий (25 амінокислот) пептид, який при рН7 захований всередині тримера і локалізована недалеко від підстави білка. Після зменшення pH з 7 до 5 молекули гемаглютиніну глобально перебудовуються, і пептид злиття не просто виходить на свободу, а переміщається в самий верхній кінець молекули і проникає в мембрану жертви.
Структура гемаглютиніну у вихідному (рН7) і в активному (рН5) станах.
Кольором відзначений пептид злиття, який в кислому середовищі змінює свою конформацію.
У нейтральному середовищі молекула гемаглютиніну нагадує пружину, затиснуту засувкою, роль якої грає пептид злиття, захований в "гідрофобний кишеню" тримера. Але варто знизити рН до 5, як пептид виходить із в'язниці і молекула ГА може перейти в нове конформационное стан. Виділяється при цьому енергія, судячи з вимірювань, досить велика, але ще не достатня для зближення мембран клітини і вірусу. Щоб вирішити це завдання, молекули гемаглютиніну діють не поодинці, а колективно. Як показали експерименти, в ході взаємодії вірусу з клітиною-мішенню утворюються розетки з шести-восьми тримерів, всередині кожної з яких знаходяться вигнуті ліпідні ділянки з радіусом
10 нм. За допомогою електронно-мікроскопічних і електрофізіологічних досліджень вдалося виявити такі локальні спучування, що отримали назву Дімпл [2].
Саме тут, на верхівках Дімпл, починається перебудова ліпідів, що призводить до утворення пори злиття. Теоретична модель цього процесу [3] полягає в наступному: білки злиття, згинаючи мембрани, не тільки зближують їх, але і забезпечують енергією, полегшуючи освіту монослойной перемички - СТАЛКОМ; ліпіди з віддалених монослоев деформуються без великих енергетичних витрат. В результаті утворюються нові проміжні структури - низькоенергетичні інтермедіати, що забезпечують злиття.
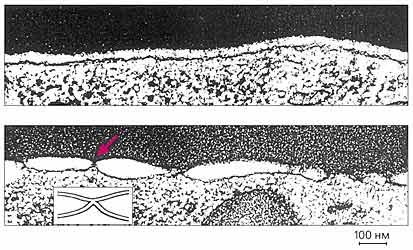
Освіта Дімпл між мембранами еритроцитів і клітин, що експресують гемаглютинін.
Вгорі - межа мембран еритроцита і клітини, що експресує ГА, рН 7.4;
внизу - то ж, але рН 4.9 - видно велику кількість контактних областей (кольорова стрілка).
На врізки показана схема контакту.
Під злиттям клітин, вірусів або клітинних органел розуміється об'єднання обмежених мембранами водних об'ємів і самих мембран. Для спостереження за цим процесом використовують розчинні у ліпідах флуоресцентні мітки. Якщо ця позначка спочатку міститься в клітинах А, то поява її в клітинах В говорить про злиття. Правда, бувають випадки, коли відбувається так зване полусліяніе, тобто об'єднуються тільки зовнішні моношарів клітин, зближені в області локального контакту. Щоб розрізнити випадки напів- і повного злиття, в клітини А вводять водорозчинний барвник. Його перетікання з одних клітин в інші свідчить про повне злиття з утворенням пори, через яку здійснюється зв'язок. Так в експерименті вивчають масове злиття, наприклад в суспензії вірусів і клітин. Однак можливості цієї методики обмежені, з її допомогою важко розібратися в деталях процесу, включаючи освіту локального контакту, поява пори і її розвиток. Подібні завдання можна вирішувати тільки з використанням більш точного методу, що дозволяє стежити за поодинокими об'єктами, тобто за допомогою методів флуоресцентної мікроскопії та сучасної електрофізіології. Вперше це було зроблено при вивченні екзоцитозу в огрядних клітках з використанням мікроелектронної техніки.
У типовому досвіді по злиттю клітини HAb2 і еритроцита при закислення навколишнього розчину до рН5 утворюється пора. Через неї протікає ємнісний струм, який заряджає еритроцит. Його зміна в часі відображає розширення пори злиття. Одночасно з мембрани еритроцита в мембрану HAb2 перетікає барвник. Зіставляючи дві криві (провідності і інтенсивності флуоресценції) в залежності від часу, помічаємо, що друга значно відстає від першої. Передбачається, що ця тимчасова затримка викликана білкової розеткою з тримерів гемаглютиніну, яка утворює своєрідний заслін потоку ліпідного зонда. Первинна пора злиття утворюється в області ліпідних Дімпл. Отже, змінюючи ліпідний склад мембран, можна впливати на весь процес. При зближенні ліпідних бішару може утворитися перемичка між прилеглими моношарами (так званий сталк), зародок майбутньої пори. Вірогідність його освіти істотно залежить від ліпідного складу. Наприклад, введення в моношарів лізофосфатіділхоліна (LPC), навіть в невеликих концентраціях, повністю пригнічує злиття. Експерименти в системі HAb2-еритроцит показали, що лізофосфатіділхоліна тут настільки ж ефективний, як і в модельних ліпідних системах. Іншими словами, пора злиття після введення LPC не виникає взагалі, хоча, судячи з появи флуоресценції, моношари об'єднуються.
Криві провідності пори (кольорова) і інтенсивності флуоресценції.
Вгорі - контроль,
внизу - та ж система, але з добавкою лізофосфатіділхоліна.
По осі ординат - провідність, по осі абсцис - час.
Отже, молекули гемаглютиніну готують поле для ліпідних ігор. Але цим справа не обмежується, білок бере участь і в наступних стадіях. У спеціальних дослідах, коли знижується активність білка (наприклад, зменшується ступінь закислення розчину), замість повного злиття і освіти пори відбувається полусліяніе, тобто ліпідний зонд перерозподіляється між клітинами, а струму немає. Це означає, що вже після формування контактів і освіти перемички білок здійснює певну роботу, необхідну для виникнення пори. Такі важливі результати отримані в групі Л.В.Черномордіка в Національному інституті здоров'я (США), а електрофізіологічні виміри виконані співробітником нашої лабораторії В.А.Фроловим [4]. Результати дослідів в поєднанні з теоретичними моделями дозволили запропонувати певну схему процесу злиття, що включає чотири стадії.
Схема процесу злиття.
Після зниження рН утворюється розетка злиття (1),
яка сприяє утворенню локального мембранного контакту (2)
і перемички, яка потім перетворюється в пору злиття (3, 4).
Однак будь-яка модель завжди відрізняється від реального об'єкта. Мембрана клітини HAb2 має інший ліпідний склад, ніж мембрана віріона, різна і щільність гемаглютиніну, а клітина HAb2 не містить білків М1 і М2. Розроблена в нашій лабораторії методика дозволяє вивчати злиття одиночного віріона з біслойной ліпідної мембраною [5]. У нейтральне середовище (буферний розчин з рН7) впорскується віріони, частина яких адсорбується на бішарі. Після цього до плоскої мембрані притискається микропипетка, заповнена розчином з рН5. Оскільки кінчик піпетки має радіус
1 мкм, досить імовірно, що всередині нього, на липидном п'ятачку, виявиться один або кілька віріонів, в мембрану яких включений флуоресцентний зонд в концентрації самогашенія. Низьке рН всередині піпетки ініціює злиття, і зонд дифундує в бішар. Що виникає при цьому розведення призводить до флуоресценції, яку можна реєструвати.
Схема експериментальної установки. Подробиці в тексті.
Електричні вимірювання показали, що поряд з латеральним потоком зонда виникає флуктуірует електричний струм, який тече через пору злиття і якісь проводять структури в мембрані вірусу. Спеціальними дослідами доведено, що справа йде саме таким чином [6]. У цих експериментах іонні канали М2 блокувалися амантадином, а закислення всередині віріона досягалося зменшенням рН (до 5) в нижньому відсіку комірки. Очевидно, що при такій постановці досвіду відразу після злиття протони з нижнього відсіку повинні спрямуватися всередину віріона через що відкривається пору, що зруйнує білкову оболонку з М1 навіть при заблокованих каналах М2. Дійсно, в цих умовах виникає електрична активність, точно така ж, як при відкритих М2 каналах. Значить, у такий спосіб можна стежити не тільки за еволюцією пори злиття в ліпідної мембрані, а й за руйнуванням білкового каркаса. Це надзвичайно важливо, тому що вихід генетичного матеріалу вірусу в цитоплазму лімітується обома захисними оболонками - білкової і ліпідної.
Отже, поєднуючи методи електронної мікроскопії та електрофізіології, вдалося виявити локальні мембранні контакти (Дімпл). Введення лізоліпіда пригнічує біологічне злиття, що доводить: першим интермедиатом процесу, як і в модельних системах, служить перемичка (сталк).
Розроблена методика вивчення злиття одиночних віріонів з ліпідними бислоями дозволяє досліджувати кінетику цього процесу, а модель злиття, що використовує принципово нові інтермедіати, вирішує проблему "енергетичної кризи".
З'ясування ролі ліпіду і білка в такому процесі має не тільки пізнавальний інтерес. У перспективі це важливо для розробки нових методів антивірусної терапії.
Результати були отримані в ході досліджень, підтриманих грантами РФФД:
№93-04-20590, №96-04-50779, №99-04-48427 і №02-04-48287.
1. Черномордик Л.В. Мелікян Г.Б. Чізмаджев Ю.А. // Биол. мембрани. 1987. Т.4. С.117-164.