Основи біохімії. Фізична хімія
Вода як розчинник
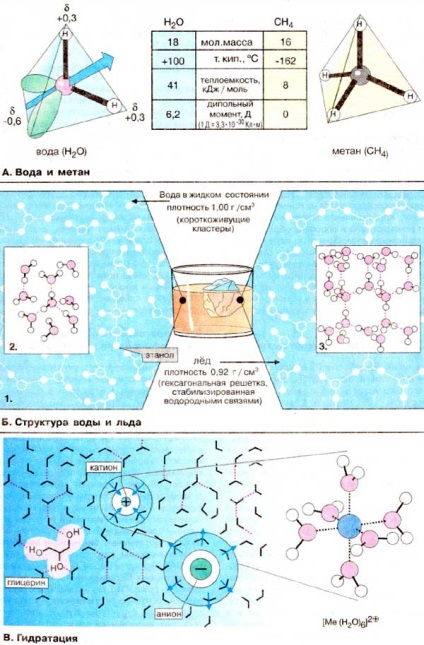
Унікальні властивості води H2 O стають очевидними при порівнянні з метаном (CH4). Обидві молекули однакові за масою і розмірами. Проте температура кипіння води на 250 о С вище в порівнянні з температурою кипіння метану. В результаті вода на поверхні Землі знаходиться в рідкому, а метан - в газоподібному стані. Висока точка кипіння води є наслідком високої теплоємності випаровування, що в свою чергу обумовлено нерівномірним розподілом електронної щільності в молекулі води. Молекула води має форму тетраедра, в центрі якого розташований атом кисню. Дві вершини тетраедра зайняті вільними електронними парами атома кисню (зеленого кольору), а інші дві - атомами водню. Тому зв'язку H-О-H розташовані під кутом один до одного. Крім того, через високу електронегативності атома кисню зв'язок О-H полярна (див. С. 14). Атоми водню несуть частковий позитивний заряд близько +0,4, а атом кисню - частковий негативний заряд близько -0,6, т. Е, молекула води є електричний диполь. Тому кожна молекула води, подібно маленькому магніту, притягує до себе за рахунок утворення водневих містків (Б) ще чотири молекули (див. С. 14). При випаровуванні води руйнування зтіх численних водневих зв'язків вимагає великих витрат енергії. Молекули метану неполярних, не є диполями і відносно слабко взаємодіють один з одним. Внаслідок цього рідкий метан випаровується при дуже низьких температурах.
Б. Структура води і льоду
Біполярний будова молекул води сприяє утворенню водневих зв'язків (див. С. 14). При цьому кожна молекула проявляє властивості як донора, так і акцептора водню. Тому у води в рідкому стані багато молекули пов'язані між собою водневими «містками» (зв'язками) (1). причому утворюються асоціати знаходяться в динамічній рівновазі. Часто утворюються тетраедричних структури, так звані "кластери" води (2). При зниженні температури частка кластерів зростає аж до початку кристалізації. При нормальному атмосферному тиску вода кристалізується при 0 o C. при цьому більшість молекул води виявляються вбудованими в гексагональну решітку (3). Оскільки в твердому стані відстань між молекулами в середньому більше, ніж в рідині, густина льоду менше в порівнянні з щільністю води. Це властивість води дуже важливо в екологічному відношенні хоча б тому, що взимку на поверхні водойм утворюється шар льоду і вони рідко промерзають до дна.
На відміну від більшості інших рідин вода є ідеальним розчинником для диссоциирующих речовин. В електричному полі того чи іншого іона молекули води утворюють регулярні структури відповідно до зарядом іона. Ця гидратная оболонка екранує іон від іонів протилежного заряду. Вода має високу константу діелектричної проникності (78), тобто в воді електростатичне тяжіння двох протилежно заряджених іонів знижується приблизно в 80 разів (1/78). Молекули води, що знаходяться у внутрішній сфері безпосередньо біля іона, практично іммобілізовані (прив'язані до цього йону) і переміщаються разом з центральним іоном. Добре розчинні у воді і нейтральні з'єднання з декількома гідроксильними групами, такі, як гліцерин (на схемі зліва) або цукру, оскільки вони здатні утворювати водневі зв'язки з молекулами розчинника.