Одновалентні іони, наприклад натрій, дійсно свя-зиваюется з кислими фосфоліпідами, але з низькою спорідненістю.
Істинне спорідненість Са 2+ до поверхні цвіттеріонов фосфоліпідних везикул близько чи трохи менше, ніж до поверхні кислих фосфоліпідів. Більш сильне зв'язування Са 2+ з кислими фосфоліпідами обумовлено не ббльшім спорідненістю до них Са 2 +. а швидше за все електростатичним ефектом більш високої щільності негативних зарядів, що призводить до зростання локальної концентрації Са 2+ на поверхні.
Зв'язування як одно-, так і двовалентних катіонів, очевидно, майже не впливає на конформацію полярних головок фосфоліпідів, принаймні для фосфатидилхоліну і фосфатіділгліцерола. При зв'язуванні з Фосфатидилсерин спостерігається іммобілізація карбоксильних груп.
Зазвичай Са 2+ зв'язується з фосфоліпідами в стехиометрии 1: 1, хоча в разі фосфатидилхолина один іон Са 2+ зв'язується з двома молекулами ліпіду. Мабуть, утворюється і комплекс з стехіометрією 1: 2, коли в результаті зв'язування металу відбувається агрегація мембран; при цьому двовалентний катіон може служити містком між двома щільно притиснутими поверхнями мембрани.
Зв'язування Са 2+ може призводити до зміни фізичного стану ліпіду. Наприклад, зв'язування Са 2+ з Фосфатидилсерин або фосфатидного кислотою може супроводжуватися переходом бішару в фазу гелю, а при взаємодії з кар-діоліпіном стабілізується гексагональна фаза. Якщо везикули складаються з суміші кислих і цвіттеріонов ліпідів, то зв'язування з Са 2+ викликає латеральне поділ фаз; при цьому можуть утворюватися великі домени в одношарових везикулах.
Свої переваги дає зв'язування фосфоліпідів з Мп 2 +. оскільки цей парамагнітний іон змінює спектр 31 Р-ЯМР. Ці зміни залежать від локальної концентрації Мп 2+ і, отже, можуть використовуватися для вимірювання поверхневого потенціалу.
З поверхнею кислих бішару міцно зв'язуються також полікатіони, наприклад полі- або гентаміцин.
Дзета-потенціал і електрокінетіческіе явища
Якщо заряджені везикули помістити в електричне поле, то вони будуть переміщатися у напрямку до електроду, заряд якого протилежний за знаком заряду везикул. Електрофоретіче-ська рухливість везикул визначається так званим дзета-потеіціалом, який дорівнює електричному потенціалу між обсягом розчину і так званої площиною Гельмгольца, паралельній площині мембрани. Ця площина відокремлює щільну частину подвійного електричного шару, яка переміщається в електричному полі разом з мембраною і знаходиться на відстані близько 2 А від зарядженої поверхні везикули. Таким чином, величина дзета-потенціалу менше, ніж величина поверхневого потенціалу, і пов'язана з поверхневим потенціалом співвідношенням, визначеним теорією Гюї - Чапмена. Вимірювання дзета-потенціалу лежить в основі одного зі стандартних методів оцінки поверхневого потенціалу і може використовуватися для вивчення зв'язування іонів з поверхнею фосфоліпідних везнкул. На електрофоретична рухливість впливає також наявність виступаючих над поверхнею бішару заряджених нелі-Пидне мембранних компонентів, наприклад білків або гангліозі-дів, і за допомогою електрокінетичних методів можна отримати певну інформацію про розподіл зарядів поблизу поверхні везикул.
Зв'язування гідрофобних іонів і мембранних зондів
Наявність поверхневого потенціалу може вплинути на зв'язування з поверхнею мембрани гідрофобних іонів і амфіфілів-них мембранних зондів. Це дозволяє використовувати деякі зонди в якості індикаторів поверхневого потенціалу. На рис. 7.9 наведені структурні формули деяких зондів. Для всіх цих сполук інтенсивність спектрального сигналу можна співвіднести з кількістю пов'язаного з мембраною зонда і, отже, з величиною поверхневого потенціалу. Такі зонди застосовували для вивчення багатьох заряджених фосфоліпідних везикул
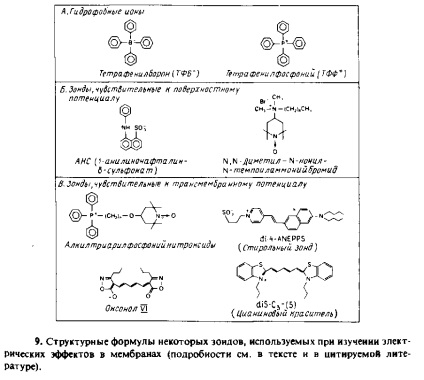
Дослідження з їх допомогою біомембран більш проблематично, оскільки спектральні характеристики зонда можуть залежати не тільки від поверхневого потенціалу, а й від рН або трансмембранного потенціалу, що сильно ускладнює інтерпретацію спостережуваних спектральних змін. Як приклад можна привести зв'язування з мітохондріями АНС і зміна спектральних характеристик нейтрального червоного при зв'язуванні з субмітохондріальнимі частинками.
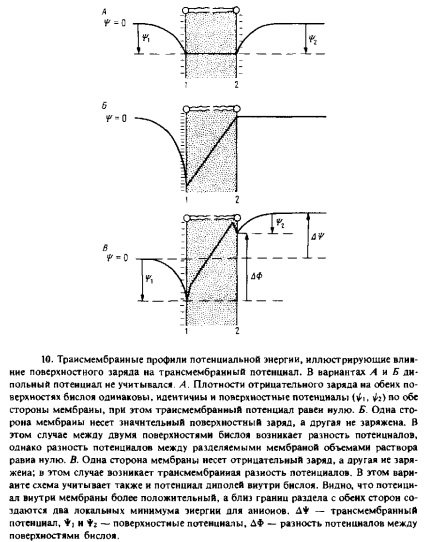
На рис. 7.10, А представлений профіль електричного потенціалу для мембрани, обидві поверхні якої негативно заряджені. При наявності на мембрані поверхневого потенціалу збільшується концентрація в цій мембрані таких гідрофобних катіонів, як ТФФ + або комплекс К + -валіноміцін. Це пов'язано з тим, що локальна концентрація іонів поблизу поверхні мембрани більше, ніж їх концентрація в обсязі. Нагадаємо, що коефіцієнт проникності може бути представлений у вигляді добутку коефіцієнта розподілу / 3 на константу швидкості переміщення іона через мембрану до, тому через велику величини / 3 проникність негативно зарядженої мембрани для гідрофобних катіонів буде вище, ніж незарядженою. Залежність провідності мембрани від поверхневого заряду задовільно описується рівнянням Гюї-Чапмена для поверхневого потенціалу.
Зауважимо, що потенціал внутрішніх диполів може впливати як на зв'язування гідрофобних іонів з поверхнею бішару, так і на константи швидкості трансмембранного транспорту, в той час як ефект симетричного поверхневого потенціалу на проникність обумовлений виключно його впливом на коефіцієнт розподілу. У разі асиметричного розподілу поверхневих зарядів ситуація ускладнюється. Подібне асиметричний розподіл ліпідів - явище аж ніяк не рідкісне. В цьому випадку існуючий на мембрані градієнт потенціалу буде ускладнювати перенесення катіонів з водної фази 1 в фазу 2 і полегшувати перенесення катіонів в протилежному напрямку.
4. Трансмембранний потенціал
Трансмембранний потенціал за визначенням є різниця електричних потенціалів між двома водними фазами, розділеними мембраною. Зв'язок між трансмембраним потенціалом і поверхневими потенціалами * i і ♦ г графічно представлена на рис. 7.10, А З схеми видно, що різниця потенціалів між двома поверхнями мембрани ДФ може відрізнятися від Д * через асиметричного розподілу заряду між двома поверхнями бислоя. Будь-яка перебуває всередині мембрани заряджена група буде переміщатися в поле з потенціалом ДФ. Д * називають також потенціалом спокою, і саме цю величину, якщо вдається, вимірюють парою електродів.
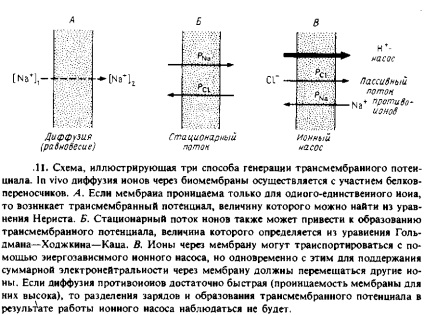
Створити трансмембранний потенціал можна декількома способами. Схематично вони зображені на рис. 7.11.
1. Рівноважні умови. Якщо мембрана проникна для якогось певного іона, наприклад Na +. і непроникна для інших, то на ній може виникнути дифузний потенціал, пропорційний логарифму відносини концентрацій проникаючого іона по одну і іншу сторони мембрани. Дифузія іона через мембрану супроводжується трансмембраним поділом зарядів, і створювана при цьому різниця потенціалів перешкоджає подальшій дифузії. Заряд, який потрібно перемістити через мембрану для створення на ній даного значення Aif, можна обчислити виходячи з ємності мембрани. Для створення Д * = 100 мВ потрібно перенести приблизно один заряд на 250 молекул фосфоліпідів. Ясно, що поверхнева щільність заряду при цьому зміниться вкрай незначно.
У рівновазі Д * визначається рівнянням Нернста:
Це ж рівняння слід використовувати в разі перенесення іона з валентністю Z. Проникність біомембран для іонів пов'язана з роботою специфічних іонних каналів. Її можна штучно збільшити за допомогою специфічних переносників іонів або іонофоров, наприклад К + -Вал-номіціна.
Стаціонарний дифузний іонний струм. Якщо мембрана проникна дял декількох іонів, то всі вони будуть переміщатися через неї. При цьому в стаціонарних умовах через відмінності в коефіцієнтах проникності для різних іонів може виникнути трансмембранная різниця потенціалів. Іншими словами, поділ зарядів на мембрані в такій ситуації буде пов'язано з тим, що одні іони дифундують через мембрану швидше за інших. Рівняння, яке описує дану ситуацію, називається рівнянням Гольдмана-Ходжкіна-Каца і для випадку двох іонів має наступний вигляд:
Переміщення іонів триватиме до тих пір, поки не встановиться рівновага.
Активний перенос іонів. Трансмембранне поділ зарядів може відбуватися і за допомогою процесів активного транспорту. Багато ферменти каталізують реакції, пов'язані з векторним перенесенням зарядів через бішар. Як приклади можна привести різноманітні АТР-залежні іонні насоси, наприклад Са 2 + -АТРазу або цитохром с-оксидазу, що представляє собою протонний насос. Тут ми відзначимо лише, що каталізуються цими ферментами реакції є Електрогене, т. Е. Супроводжуються переносом зарядів через бішар. Очевидно, в такій системі повинен існувати якийсь трансмембранний нейтралізуючий іонний потік. В системі, представленої на рис. 7.11, таким потоком є пасивний контртранспорт іонів CI
що виникає при роботі протонного насоса. Як і в разі пасивних іонних потоків, швидкість потоку протиіонів буде менше, ніж швидкість активного процесу, і в результаті сумарний потік іонів через бішар НЕ буде електронейтральний і на мембрані виникне різниця потенціалів №. Якщо проникність бішару для нейтралізують іонів зробити досить великий, то поділу зарядів вже не буде. На цьому принципі грунтується використання іонофоров для усунення трансмембранного електричного потенціалу, створюваного як на біологічних мембранах, так і в модельних системах.