
Головна | Про нас | Зворотній зв'язок
Оксиди азоту відіграють ключову роль в утворенні фотохімічного "смогу" (див. Відповідну лекцію), впливають на руйнування озонового шару (див. Відповідну лекцію). Таким чином, ці забруднення атмосфери оксидами азоту надає як локальні, так і глобальні ефекти на стан навколишнього середовища.
Забруднення атмосфери оксидами азоту в цілому порівняно невелика. Однак в районах з розвинутою хімічною промисловістю, зокрема в околицях заводів з виробництва азотної кислоти, є локальні зони підвищеного вмісту NO, NO2 в повітрі.
Сполуки азоту в тропосфері представлені в основному оксидами азоту, аміаком та солями амонію, а також азотною кислотою і нітратами. Серед оксидів азоту слід виділити оксид діазота (N2 О), монооксид (NO) і діоксид азоту (N02). Інші сполуки азоту з киснем (N03. N2 O3. N2 O4. N2 O5) в умовах тропосфери є нестійкими. Так, наприклад, триоксид діазота і азотний тетраоксид легко розкладаються з утворенням NO і NO2:
Триоксид азоту порівняно швидко піддається фотодиссоциации або вступає у взаємодію з іншими домішками:
Пентаоксид діазота також є нестійким в тропосфері з'єднанням і розкладається з утворенням триоксиду діазота і кисню або під дією вологи перетворюється в азотну кислоту:
Тому під загальною формулою оксидів азоту NOx зазвичай мають на увазі NO, N02 і N2 0.
Основні процеси виведення N2 0 з атмосфери пов'язують з протіканням процесів фотодиссоциации:
або з взаємодією з синглетно порушеною атомом кисню:
N2 0 + 0 (1 D) ® 2NO
Дві останні реакції протікають з приблизно однаковою швидкістю. Оскільки в тропосфері концентрація синглетно збуджених атомів кисню є низькою і практично немає випромінювання з довжиною хвилі l £ 250 нм, молекули N2 Про володіють великим часом життя і можуть переміститися в стратосферу. У стратосфері в зв'язку з ростом концентрації 0 (1 D) атомів і зміною спектру проходить сонячного випромінювання швидкість процесів руйнування молекул N2 Про різко зростає. Тому концентрація N2 О на висоті 35 км приблизно в 10 разів менше, ніж в тропосфері.
Основні природні джерела оксидів азоту (процеси денітрифікації, окислення NH3. А також окислення азоту при розрядах блискавок) щорічно поставляють в тропосферу від 21 до 89 млн т NOх в перерахунку на елементний азот. Крім цього в результаті антропогенних викидів ще близько 20 млн т азоту у вигляді оксидів викидається в атмосферу. Як природні, так і антропогенні викиди переважно містять оксид азоту NO.
Одним з основних джерел утворення оксиду азоту є окислення азоту повітря, що супроводжує всі процеси горіння, в яких в якості окислювача використовується повітря. З підвищенням температури збільшується рівноважний кількість оксиду азоту в повітрі. Процеси спалювання викопного палива на теплових електростанціях і спалювання палива в двигунах автомобілів є основними джерелами забруднення атмосфери оксидами азоту.
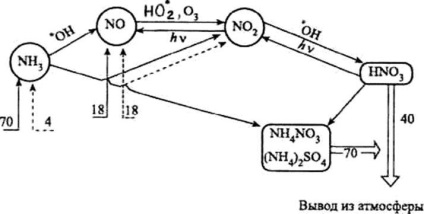
Атмосферне цикл сполук азоту (числа - млн т елементного азоту в рік):
® - природні надходження сполук азоту;
---® - антропогенні надходження сполук азоту;
Þ - висновок з атмосфери
У тропосфері N0, взаємодіючи з гідропероксідним радикалом, переходить в діоксид азоту:
Інший можливий шлях окислення оксиду азоту - взаємодія з озоном:
Діоксид азоту в тропосфері в присутності випромінювання довжиною хвилі l <398 нм разлагается с образованием оксида азота и атома кислорода:
Утворений монооксид азоту знову піддається процесу окислення, а атомарний кисень призводить до появи в тропосфері озону.
Важливою частиною атмосферного циклу сполук азоту (див. Рис.) Є утворення азотної кислоти. Приблизно 44% азотної кислоти в тропосфері утворюється в результаті взаємодії діоксиду азоту з гідроксильних радикалом:
Близько 24% HNO3 з'являється в атмосфері в результаті взаємодії пентаоксиду діазота з молекулами Н2 0 з рівняння (1). До 28% всієї виділяється в атмосфері азотної кислоти утворюється при взаємодії триоксиду азоту з органічними кислородсодержащими радикалами.
Частина азотної кислоти розкладається з утворенням діоксиду або триоксиду азоту, які знову включаються в атмосферне цикл сполук азоту (див. Рис.):
На відміну від сірчаної азотна кислота може довгий час залишатися в атмосфері в газоподібному стані, так як вона погано конденсується. Пари азотної кислоти поглинаються в атмосфері краплями хмар або частками аерозолю.
Основна кількість азотної кислоти виводиться з тропосфери з атмосферними опадами у вигляді розчинів HN03 і її солей.
Важливу роль в атмосферних процесах за участю сполук азоту грає аміак. У водному розчині аміак має лужну реакцію, внаслідок чого може нейтралізувати атмосферні кислотні з'єднання:
Ці хімічні реакції призводять до утворення сульфату і нітрату амонію.
Найважливішим джерелом атмосферного аміаку є грунт. Знаходяться в грунті органічні речовини піддаються мікробіологічної деструкції. Аміак є одним з продуктів руйнування органічних речовин. Особливо велика кількість аміаку виділяється в процесі розпаду сечі домашніх тварин. Наприклад, в Європі це джерело виявляється навіть більш значним, ніж виділення аміаку з грунту. Істотним джерелом служать також виробництво та внесення в грунт азотних добрив. Надходження аміаку в атмосферу в результаті згоряння вугілля або моторного палива незначно.
Щорічно з природних джерел в атмосферу надходить близько 70 млн т NH3 в перерахунку на азот. Антропогенний внесок у забруднення атмосфери аміаком складає всього близько 4 млн т.
З атмосферними опадами і в результаті процесів сухого осадження щорічно близько 70 млн т сполук амонію виводиться з атмосфери. Частина аміаку (від 3 до 8 млн т на рік) вступає у взаємодію з вільними радикалами, в основному з гідроксильних радикалом:
Надалі · NH2 легко окислюється до монооксиду азоту.