
Головна | Про нас | Зворотній зв'язок
Основні надходження неорганічних сполук сірки в тропосферу пов'язані з антропогенними джерелами. На їх частку припадає приблизно 65% всіх надходжень неорганічних сполук сірки в атмосферу. Близько 95% з цієї кількості становить діоксид сірки.
З природних джерел надходження неорганічних сполук сірки слід виділити хвильову діяльність в океанах, що приводить до утворення аерозолів. Загальна кількість сірки, що міститься в аерозолях у вигляді сульфатів магнію і кальцію, оцінюється в 44 млн т на рік, що становить приблизно 30% від її надходження в атмосферу у вигляді неорганічних сполук.
Як вже зазначалося вище, в тропосфері відбуваються процеси окислення сполук сірки, основним окислювачем в яких виступають вільні радикали. Сірководень, наприклад, послідовно, в ряді стадій окислюється до SO2. Детальний механізм цього процесу ще не встановлено. Найбільш ймовірним є протікання наступних реакцій:
HS · + 02 ® SO + · ОН
Отриманий в результаті діоксид сірки, як і S02. що надходить з інших джерел, окислюється далі. Механізм цього процесу вивчений більш детально.
Окислювання діоксиду сірки може протікати в газовій фазі - перший шлях, в твердій фазі (окисленню передує адсорбція) - другий шлях і в рідкій фазі (окисленню передує абсорбція) - третій шлях.
Газофазне окислення (перший шлях) історично є першою спробою пояснити процеси окислення діоксиду сірки в атмосфері. Довгі роки основний механізм процесу пов'язували з утворенням діоксиду сірки в збудженому стані, який, реагуючи з молекулярним киснем, утворює SO3:
Утворений SO3 вступає у взаємодію з молекулою води:
Однак, як показали дослідження останніх десятиліть, розглянутий механізм є можливим, але ніяк не основним процесом окислення SO2 в газовій фазі.
Таким чином даний механізм окислення не відіграє суттєвої ролі в трансформації сполук сірки в тропосфері, а провідну роль відіграють вільні радикали. Протікають при цьому процеси можна представити наступними рівняннями реакцій:
Триоксид сірки - сірчаний ангідрид - легко взаємодіє з частинками атмосферної вологи і утворює розчини сірчаної кислоти [см. рівняння (1)], які, реагуючи з аміаком або іонами металів, присутніми в частинках атмосферної вологи, частково переходять у відповідні сульфати. В основному це сульфати амонію, натрію, кальцію. Освіта сульфатів відбувається і в процесі окислення на поверхні твердих частинок, присутніх в повітрі. В цьому випадку стадії окислення передує адсорбція, часто супроводжується хімічною реакцією (другий шлях окислення діоксиду сірки):
Третій шлях окислення діоксиду сірки в тропосфері пов'язаний з попередньою абсорбцією SO2 краплями атмосферної вологи. У дощову погоду і при високій вологості атмосфери цей шлях окислення може стати основним у процесі трансформації діоксиду сірки. В якості окислювача в природних умовах часто виступає пероксид водню. При високих значеннях рН, коли в розчині в основному знаходяться іони SO3 2-. швидкість окислення помітно зростає. Кінцевим продуктом окислення, як і в разі окислення в газовій фазі, є сірчана кислота, яка в подальшому може перейти в сульфати.
Крім процесів хімічної трансформації діоксиду сірки в сірчану кислоту і сульфати стік (висновок з атмосфери) цих сполук відбувається в результаті процесів мокрого (з атмосферними опадами) і сухого (при контакті з поверхнею грунту, водойми або з рослинністю) осадження.
Представлена на рис. схема наочно ілюструє тропосферні частина циклу неорганічних сполук сірки.
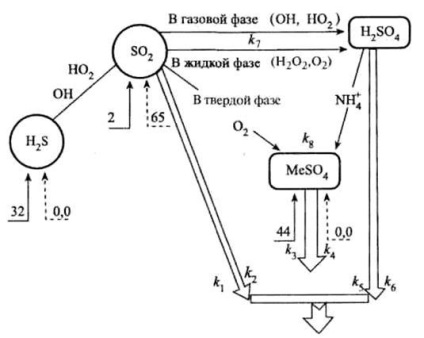
Трансформація неорганічних сполук сірки в тропосфері (числа - млн т елементної сірки в рік):
® природні надходження сполук сірки;
---® антропогенні надходження сполук сірки;
Þ висновок з атмосфери.
Необхідно відзначити, що діоксид сірки - один з найбільш шкідливих газів з числа поширених забруднювачів повітря. Він особливо небезпечний для здоров'я людей, які страждають захворюваннями дихальних шляхів. Встановлено лінійна кореляція між концентрацією SO2 в повітрі і частотою заболева-ний населення на хронічний бронхіт:
де у - відсоток захворювання бронхітом; х - концентрація SО2 в повітрі, мг / м 3.
Із зазначеної залежності випливає, що при концентрації SО2 в повітрі 0,5 мг / м 3 захворюваність бронхітом у населення складе 6%, при концентрації 1,0 мг / м 3 - 13,2%, при 5 мг / м 3 - 71, 2%, а при концентрації 6,8 мг / м 3 все населення захворіє бронхітом. Ці прогнози збігаються з результатами досліджень, проведених в Німеччині та інших європейських країнах.
Основну шкоду навколишньому середовищу завдає не стільки сам SO2. скільки продукт його окиснення - SO3. Оскільки потім відбувається утворення в атмосферної вологи сірчаної кислоти [см. рівняння (1)], а це призводить до випадання так званих кислотних дощів. Особливо поширеною-нено це явище в країнах Скандинавії, Північній Європі, на півночі США і півдні Канади. Через випадання кислотних дощів зменшується рН прісноводних водойм, що призводить до загибелі риб та інших водних організмів (докладніше див. Лекцію про закислення водойм). Під дією кислотних дощів прискорено корродируют металоконструкції, порушується цілісність лакокра-соковитих покриттів, руйнуються будівлі і пам'ятники архітектури. Так, атмосферна сірчана кислота реагує з мармуром (СаСО3) з утворенням CaSO4. що призводить до лущення каменю.
У кислому середовищі зростає розчинність Аl (ОН) 3 При концентрації-ції> 0,2 мг / л Аl 3+ в воді токсичний для риб, до того ж алюміній пов'язує фосфати, що призводить до зниження поживних запасів у водоймі. У кислому середовищі підвищується можливість переходу в розчин і іонів інших металів, що також створює небезпеку токсичного забруднення водних і ґрунтових екосистем.
Кислотні дощі впливають на структуру і будову грунтів, призводять до загибелі рослин (головним чином хвойних дерев). При закислення грунтів відбувається вилуговування іонів кальцію, магнію і калію, воз-розтане рухливість іонів токсичних металів, змінюється склад ґрунтових мікроорганізмів.