Захисні білки дозволяють уберегти організм від вторгнення атакуючих його бактерій, вірусів і від проникнення чужорідних білків (узагальнена назва чужорідних тіл - антигени).
Роль захисних білків виконують імуноглобуліни (інша їх назва - антитіла), вони розпізнають антигени, які проникли в організм, і міцно зв'язуються з ними.
В організмі ссавців, включаючи людину, є п'ять класів імуноглобулінів: M, G, A, D і E, їх структура, як випливає з назви, глобулярна, крім того, всі вони побудовані подібним чином. Молекулярна організація антитіл показана на слайді на прикладі імуноглобуліну класу G. Молекула містить чотири поліпептидні ланцюги, об'єднані трьома дисульфідними містками S-S (на слайді вони показані з потовщеними валентними зв'язками і великими символами S), крім того, кожна полімерна ланцюг містить внутріцепние дисульфідні перемички.
Дві великі полімерні ланцюги (виділені синім кольором) містять 400-600 амінокислотних залишків.
Дві інші ланцюга (виділені зеленим кольором) майже вдвічі коротше, вони містять приблизно 220 амінокислотних залишків. Всі чотири ланцюга розташовані таким чином, що кінцеві H2 N-групи спрямовані в одну сторону.
Після контакту організму з чужорідним білком (антигеном), клітини імунної системи починають виробляти імуноглобуліни (антитіла), які накопичуються в сироватці крові. На першому етапі основну роботу здійснюють ділянки ланцюгів, що містять кінцеві H2 N (на рис. 27 відповідні ділянки відзначені світло-синім і світло-зеленим кольором). Це області захоплення антигенів. У процесі синтезу імуноглобуліну ці ділянки формується таким чином, щоб їх будова і конфігурація максимально відповідали структурі наблизився антигену (як ключ до замка, подібно ферментам, але завдання в даному випадку інші). Таким чином, для кожного антигену в якості імунної відповіді створюється строго індивідуальне антитіло. Настільки «пластично» змінювати будову в залежності від зовнішніх факторів, крім імуноглобулінів, не може жоден відомий білок. Ферменти вирішують задачу структурного відповідності реагенту іншим шляхом - за допомогою гігантського набору різноманітних ферментів в розрахунку на всі можливі випадки, а імуноглобуліни кожен раз заново перебудовують «робочий інструмент». Понад те, шарнірний ділянку імуноглобуліну забезпечує двом областям захоплення деяку незалежну рухливість, в результаті молекула імуноглобуліну може «знайти» відразу два найбільш зручних для захоплення ділянки в антигене з тим, щоб його надійно зафіксувати, це нагадує дії ракоподібних істоти.
Далі включається ланцюг послідовних реакцій імунної системи організму, підключаються імуноглобуліни інших класів, в результаті відбувається дезактивація чужорідного білка, а потім знищення і видалення антигену (стороннього мікроорганізму або токсину).
Після контакту з антигеном максимальна концентрація імуноглобуліну досягається (в залежності від природи антигену і індивідуальних особливостей самого організму) протягом декількох годин (іноді декількох днів). Організм зберігає пам'ять про такому контакті, і при повторній атаці таким же антигеном імуноглобуліни накопичуються в сироватці крові значно швидше і в більшій кількості - виникає набутий імунітет.
Наведена класифікація білків носить певною мірою умовний характер, наприклад білок тромбін, згаданий серед захисних білків, по суті являє собою фермент, що каталізує гідроліз пептидних зв'язків, тобто, відноситься до класу протеаз.
До захисних білків часто відносять білки зміїної отрути і токсичні білки деяких рослин. оскільки їх завдання - вберегти організм від пошкоджень.
Є білки, функції яких настільки унікальні, що це ускладнює їх класифікацію. Наприклад, білок монеллін, що міститься в одному з африканських рослин, - дуже солодкий на смак, він став предметом вивчення як нетоксичний речовина, яке може бути використане замість цукру для запобігання ожиріння. Плазма крові деяких антарктичних риб містить білки з властивостями антифризу, який оберігає кров цих риб від замерзання.
Захисними властивостями володіють білки системи згортання крові. наприклад фібриноген, тромбін. Вони беруть участь у формуванні тромбу, який закупорює пошкоджену судину і перешкоджає втраті крові.
5 Скоротливі і рухові білки надають організму здатність скорочуватися, змінювати форму і переміщатися, перш за все, мова йде про м'язи. 40% від маси всіх білків, що містяться в м'язах, становить міозин (mys, myos, грец. - м'яз). Його молекула містить одночасно фибриллярную і глобулярную частина.
Такі молекули об'єднуються в крупні агрегати, що містять 300-400 молекул.
При зміні концентрації іонів кальцію в просторі, що оточує м'язові волокна, відбувається оборотна зміна конформації молекул - зміна форми ланцюга за рахунок повороту окремих фрагментів навколо валентних зв'язків. Це призводить до скорочення і розслаблення м'язів, сигнал для зміни концентрації іонів кальцію надходить від нервових закінчень в м'язових волокнах. Штучне скорочення м'язів можна викликати дією електричних імпульсів, що призводять до різкої зміни концентрації іонів кальцію, на цьому заснована стимуляція серцевого м'яза для відновлення роботи серця.
Завдяки ковзанню відносно один одного Актинові (актинії) і миозинових (міозин) протофібрілл відбувається скорочення м'язів, а також нем'язові внутрішньоклітинні скорочення. Рух війок і джгутиків пов'язано з ковзанням щодо один одного мікротрубочок, що мають білкову природу.
Деякі арктичні і антарктичні риби містять в крові білки - антифризи, що запобігають її заморожування.
Деякі білки при виконанні своїх функцій наділяють клітку здатністю або скорочуватися, або пересуватися. До таких білків відносять актин і міозин - фібрилярні білки, які беруть участь в скороченні скелетних м'язів. Інший приклад таких білків - тубулін, з якого побудовані клітинні органели - мікротрубочки. Микротрубочки в період поділу клітини регулюють розбіжність хроматид. Микротрубочки - важливі елементи війок і джгутиків, за допомогою яких клітини пересуваються.
Однак існує велика кількість білків, що мають унікальні функції, які не ввійшли в цю досить просту класифікацію.
6 Регуляторні білки. частіше звані гормонами, беруть участь в різних фізіологічних процесах.
До регуляторних білків відносять велику групу білкових гормонів, що беруть участь в підтримці сталості внутрішнього середовища організму, які впливають на специфічні клітини-мішені.
Багато гормонів є олігопептиди або білками (наприклад, інсулін, глюкагон [антагоніст інсуліну], адренокортикотропний гормон та ін.).
Гормон інсулін складається з двох # 945; -ланцюгів, з'єднаних дисульфідними містками.
Інсулін - гормон, що утворюється в клітинах острівців Лангерганса в підшлунковій залозі. Він грає найважливішу роль в метаболізмі глюкози в крові.
Крім того, до регуляторних відносять білки, приєднання яких до інших білків або іншим структурам клітини регулює їх функцію. Наприклад, білок кальмодулін в комплексі з чотирма іонами Са2 + може приєднуватися до деяких ферментів, змінюючи їх активність.
Регуляторні ДНК-зв'язуючі білки, приєднуючись в певні моменти до специфічним ділянкам ДНК, можуть регулювати швидкість зчитування генетичної інформації.
У гіпофізі мозку синтезується гормон, який регулює ріст організму. Існують регуляторні білки, контролюючі біосинтез різних ферментів в організмі.
На малюнку показаний - БІЛОК ІНСУЛІН - у вигляді об'ємної моделі і в формі третинної структури. Складається з двох # 945; -спіральні ланцюгів, пов'язаних двома дисульфідними містками (порівняй з рис. 2, де його будова показано схематично)
МОЛЕКУЛА ИНСУЛИНА. побудована з 51 амінокислотного залишку, фрагменти однакових амінокислот відзначені відповідної забарвленням фону. Вміщені в ланцюзі залишки амінокислоти цистеїну (скорочена назва ЦІС) утворюють дисульфідні містки -S-S-, які пов'язують дві полімерних молекули, або утворюють перемички всередині одного ланцюга.
Рецепторная (сигнальна) функція білків
Сигнальні молекули (гормони, нейромедіатори) діють на внутрішньоклітинні процеси через взаємодію зі специфічними білками-рецепторами. Так, гормони, що циркулюють в крові, знаходять клітини-мішені і впливають на них, специфічно зв'язуючись з білками-рецепторами, зазвичай вбудованими в клітинну мембрану. Для гідрофобних регуляторних молекул, що проходять через клітинну мембрану, рецептори локалізуються в цитоплазмі клітин.
Деякі білки, вбудовані в клітинну мембрану, здатні змінювати свою структуру під впливом зовнішнього середовища.
Так відбувається прийом сигналів ззовні і передача інформації в клітку.
Прикладом може служити фітохром - світлочутливий білок, який регулює фотоперіодичну реакцію рослин, і опсин - складова частина родопсину пігменту -. інтегральний мембранний білок, що знаходиться в клітинах сітківки ока.
Фітохром (від Фіто. І грец. Chroma - колір, фарба) блакитний пігмент з групи складних білків - хромопротеидов; присутній в клітинах фотосинтезуючих організмів. Вперше виявлений амерікансканскім біохіміком У. Батлером в 1959 в сім'ядолях проростків турнепсу, вирощених в темряві.
Блакитні фітохромів відносяться до фотосинтетичний неактивним пігментів.
Однак встановлено, що під контролем фітохрому знаходяться синтези біополімерів (ДНК, РНК, білків), системи біосинтезу хлорофілу, каротиноїдів, антоціанів, органічних фосфатів, вітамінів. Ф. прискорює катаболітіческій розпад полісахаридів, жирів і резервних білків, активує клітинне дихання і Окислювальне фосфорилування.
Ферменти існує в двох взаимопревращающихся формах - Ф660 і Ф730, різних за спектрами поглинання. Під дією червоного світла з довжина хвилі # 955; = 660 нм неактивний Ф660 перетворюється в активний Ф730. Зворотне перетворення відбувається або в темряві, або при освітленні червоним світлом з # 955; = 730 нм. Вважають, що ці взаємоперетворення обумовлені цис-транс-ізомеризації хромофора Ф. і конформаційними перебудовами білка.
Сигнальні молекули (гормони, нейромедіатори) діють на внутрішньоклітинні процес через взаємодію зі специфічними білками рецепторами.
Гормони, що циркулюють в крові, знаходять клітини-мішені і впливають на них, специфічно зв'язуючись з білками-рецепторами, зазвичай вбудованими в клітинну мембрану. Для гідрофобних регуляторних молекул, що проходять через клітинну мембрану, рецептори локалізуються в цітолазме клітин.
Сигнальні молекули (гормони, нейромедіатори) діють на внутрішньоклітинні процеси через взаємодію зі специфічними білками-рецепторами. Так, гормони, що циркулюють в крові, знаходять клітини-мішені і впливають на них, специфічно зв'язуючись з білками-рецепторами, зазвичай вбудованими в клітинну мембрану. Для гідрофобних регуляторних молекул, що проходять через клітинну мембрану, рецептори локалізуються в цитоплазмі клітин.
Найбільш важливими з них є фітохромів А і В (phyA and phyB). фітохром А
виконує безліч різних фоторегуляторних функцій. За його участю відбувається стимулювання і інгібування проростання насіння, індукція де-етіоляція, регуляція синтезу різних ферментів, регуляція розвитку кореня, стимуляція цвітіння і регуляція циркадних ритмів.
Цикл основних змін родопсина в паличках сітківки
Родопсином (від грец. Rhodon - троянда і opsis - зір), зоровий пурпур, осн. зоровий пігмент паличок сітківки хребетних (крім деяких риб і земноводних на ранніх стадіях розвитку) і безхребетних тварин.
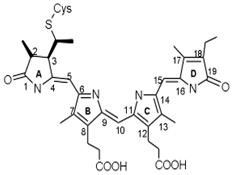
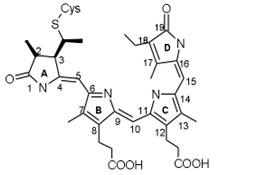
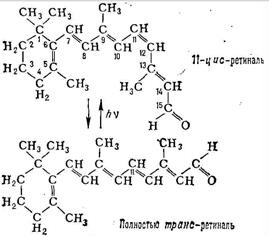
За химич. природі родопсин - складний білок (хромопротеїд), до складу якого входить 11-цис-ретиналь (Хромофорную група), гликопротеид, т. е. білок, сполучений з цукрами, і ліпіди (т. н. опсин-вая частина). Мовляв. маса родопсина хребетних ок. 40 000, головоногих молюсків-ок. 70 000. Р.- осн. структурно-функціональний компонент зовнішнього сегмента паличок (див. Зір, Сітківка, Фоторецептори).
Зоровий акт починається поглинанням Р. кванта світла (максимум спектра поглинання Р.- ок. 500 нм). При цьому відбувається ізомеризація 11-цис-ретиналь в повністю транс-форму (див. Формули), що призводить до поступового розкладання (фотолизу) молекули Р. зміни іонного транспорту в фоторецепторі і виникненню електричні. сигналу, к-рий передається нервовим елементам сітківки. Регенерація Р. здійснюється або шляхом синтезу з 11-цис-ретиналь і звільнився після фотолиза опсина, або при поглинанні другого кванта одним з проміжних продуктів фотолізу, а також в процесі синтезу нових дисків зовнішнього сегмента сітківки (останню путь для паличок основний).
У клітинних оболонках некоторихрих галофільних бактерій виявлено пігмент, до складу якого також входять ретиналь, гликопротеид і ліпіди. Цей бактеріальний радапсін (структура його остаточно не встановлена), по-видимому, бере участь у фотосинтезі поряд з ін. Пігментами бактерій.
Особливе значення для дії фітохрому має його оборотність: цей хромопротеїд (складний білок, що містить, крім амінокислот, також фарбують компоненти) зустрічається в двох формах, здатних перетворюватися одна в іншу.
Блакитний фітохром 660 (Ф 660) має максимум поглинання в світло-червоній області спектра з довжиною хвилі 660 нм, а зелено-блакитний фітохром 730 (Ф 730) - в темно-червоній області спектра з довжиною хвилі 730 нм.
При висвітленні світло-червоним світлом неактивний Ф 660 перетворюється в фізіологічно активний Ф 730, а при освітленні темно-червоним світлом відбувається перетворення Ф 730 в Ф 660.
8 Харчові і запасні білки. як випливає з назви, служать джерелами внутрішнього харчування, частіше для зародків рослин і тварин, а також на ранніх стадіях розвитку молодих організмів.
До харчових білків відносять альбумін - основний компонент яєчного білка, а також казеїн - головний білок молока.
Під дією ферменту пепсину казеїн в шлунку створаживается, це забезпечує його затримку в травному тракті і ефективне засвоєння. Казеїн містить фрагменти всіх амінокислот, необхідних організму.
У ферритине, який міститься в тканинах тварин, запасені іони заліза.
До запасних білок відносять також міоглобін. за складом і будовою нагадує гемоглобін. Міоглобін зосереджений, головним чином, в м'язах. його основна роль - зберігання кисню. який йому віддає гемоглобін. Він швидко насичується киснем (набагато швидше, ніж гемоглобін), а потім поступово передає його різних тканин за наступною фізичному навантаженні і кисневої недостатності його вивільнити ..
Все це розмаїття функцій виникає з дуже простого набору 20 амінокислот, з яких побудована поліпептидний ланцюг білка. Саме різну кількість і різні поєднання цих амінокислот в ланцюзі і визначає унікальність того чи іншого білка.