Число молекул субстрату, претерпівает зміна протягом хвилини, в розрахунку на одиницю ваги ферменту при оптимальних умовах його дії називається молекулярною активністю ферменту. При збільшенні кількості ферментів швидкість ферментативної реакції підвищується до певної межі, який характеризується кількістю субстрату, доступним дії ферменту. У той же час, при постійній концентрації ферменту збільшення кількості субстрату призводить спочатку до швидкого, потім до більш повільного зростання швидкості ферментативної реакції, поки не досягається максимальна швидкість, що залишається практично незмінною при подальшому збільшенні концентрації субстрату. ЗСФРОКС: V = Vmax / 1 + Km / S, де V - швидкість ферментативної реакції, Vmax - максимальна швидкість її при нескінченно великій концентрації субстрату, S - концентрація субстрату в моль / л, Кm - константа Міхаеліса.
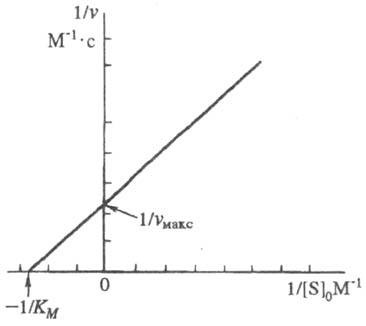
Вона відповідає концентрації субстрату, при якій швидкість реакції дорівнює половині максимальної і служить мірою хімічної спорідненості меду ферментом і субстратом, мірою їх здатності утворювати фермент-субстратної комплекс.
Регуляція активності ферментів. Різні способи активації і інгібування ферментів.
Фактори, що регулюють активність ферментів, різноманітні за своєю природою. Фізичні фактори (температура, тиск, світло, магнітне поле, електричні імпульси) надають менш специфічну дію, ніж хімічні. У свою чергу дія останніх також може бути розділене на кілька типів. Одні хімічні речовини зв'язуються з активним центром ферменту, наприклад субстрати, кофактор, конкурентні інгібітори, що призводить до зміни ферментативної активності. Інші речовини взаємодіють із спеціальними ділянками на поверхні молекули певного типу ферменту, що не мають безпосереднього відношення до центрів каталітичної активності, але тим не менш приводять до її зміни. Активатори органічної природи: жовчні кислоти (активують підшлункову ліпазу), ентерокіназа (активує трипсиноген), глутатіон, цистеїн, вітамін С (підвищують активність оскідоредуктаз).
Активатори неорганічної природи: наприклад, HCl активує пепсиноген, іони ме талій (Na, Cl, K, Mg, Mn, Zn). Якщо інгібітор зв'язується з молекулою ферменту слабкими зв'язками, то такий інгібітор легко видаляється і активність ферменту відновлюється. Якщо інгібітор зв'язується з молекулою ферменту міцними ковалентними зв'язками, то настає необоротне пригнічення активності ферменту.
Регуляція дії ферментів, аллостерічеськіє механізми, фосфорилювання - дефосфорілірованіе. Приклади метаболічних шляхів, регульованих цими механізмами. Класифікація ферментів, її принципи. Характеристика оксидоредуктаз.
У живій клітині швидкість ферментативних реакцій знаходиться під строгим контролем, що дозволяє кожній метаболічної ланцюжку реакцій постійно змінюватися, пристосовуючись до мінливих потреб клітини в продукті. У кожній метаболічної ланцюга є фермент, який задає швидкість всьому ланцюжку реакцій. Він називається регуляторним ферментом. Існує кілька способів регуляції дії ферментів: зміна активності ферменту при його постійної концентрації; зміна концентрації ферменту, зазвичай в результаті прискорення (індукції) або гальмування (репресії) синтезу ферменту. Аллостеріческім механізмом регуляції активності ферментів називають регуляторний механізм, в якому контроль активності ферменту реалізується шляхом зміни конформації білкової молекули, индуцируемого зв'язуванням метаболіту-регулятора в особливому (аллостеріческому) центрі, просторово віддаленому від активного центру. Фосфорилювання - процес перенесення залишку фосфорної кислоти від фосфорилюються агента- донора до субстрату, як правило, що каталізує ферментами і веде до утворення ефірів фосфорної кислоти. Дефосфорілірованіе - відщеплення залишку фосфорної кислоти від молекули фосфорсодержащего з'єднання. КФ 1: Оксидоредуктази, КФ 2: Трансферази, КФ 3: Гідролази, КФ 4: Ліази, КФ 5: Ізомерази, КФ 6: Лігази. Оксидоредуктази, каталізують окислення або відновлення. Приклад: каталаза, алкогольдегидрогеназа.