При заповненні електронами атомних орбіталей дотримуються наступні три правила:
1. Принцип стійкості (принцип мінімальної енергії). Орбіталі заповнюються починаючи з мають найнижчу енергію і далі в порядку її підвищення. У цьому випадку енергія атома є мінімальною, а стійкість - максимальної.
енергетична послідовність легко може бути описана за допомогою правила суми двох перших квантових чисел n + l. Це правило носить назву правила Клечковского (1951 г.):
При заповненні орбітальних оболонок атома більш кращі (більш енергетично вигідні), і, отже, заповнюються раніше ті стану, для яких сума головного квантового числа n і побічного (орбітального) квантового числа l, тобто n + l, має менше значення.
Наприклад, орбиталь 4s. для якої n + l = 4 + 0 = 4, заповнюється раніше, ніж орбиталь 3d. де сума n + l = 3 + 2 = 5.
У разі рівного розподілу сум нижче по енергії знаходиться орбиталь з меншим значенням головного кантовиє числа. Так, орбиталь 3d має нижчу енергію, ніж 4р.
Звичайний порядок заповнення атомних орбіталей:
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f =5d <6p <7s <5f=6d …
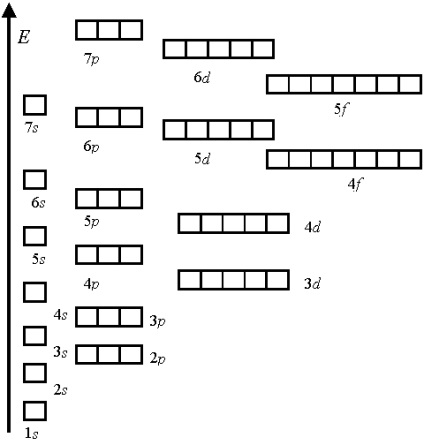
Кількість орбіталей на кожному електронному рівні.
2. Принцип Паулі. Ватомо не може бути двох електронів, у яких всі чотири квантові числа були б однаковими.
На будь-який орбіталі може знаходитися не більше двох електронів і то лише в тому випадку, якщо вони мають протилежно спрямовані спини. Такі електрони називаються спареними.
3. Правила Гунда (1925 г.). Атом в основному стані повинен мати максимально можливе число неспарених електронів в межах певного підрівня.
Заповнення енергетичних орбіталей азоту: а - правильна схема, б - неправильна схема.