РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
2. Будова атома
2.4. Електрон. електронні шари
Сучасна теорія електронної будови атома ґрунтується на важливому розділі фізики - квантової механіки, який описує властивості мікроскопічних об'єктів.
Згідно з уявленнями квантової механіки, електрон як мікрочастинка має двоїсту природу: проявляє властивості частинки і хвилі. Розглядається траєкторія його руху, а лише ймовірність знаходження в просторі навколо ядра. Простір навколо ядра, в якому найімовірніше (
90%) знаходиться електрон, називають орбіталлю. Кожен електрон в атомі займає певну орбиталь і утворює електронну хмару. Електронне хмара - це сукупність різних положень електрона, який знаходиться в постійному русі.
Графічно орбіталі зображують у вигляді осередку, яку також називають квантової осередком а електрони, які розміщуються на орбіталі, показують стрілками. На кожній орбіталі може знаходитися один або (максимально) два електрона з різними квантовими характеристиками - спинами 1 (принцип заборони Паулі).
Ці два електрона, що мають протилежні спіні, позначають в осередку протилежно спрямованими стрілками Такі електрони називають спареними. Якщо на орбіталі знаходиться один електрон, то його називають неспареним і позначають
Найважливішою характеристикою електрона (при розгляданні його властивостей в хімії) є енергія. Електрони, які мають однакову або близьку за рівнем енергію, рухаються по близьких за розмірами орбиталях, утворюють енергетичні рівні (електронні шари, електронні оболонки). їх нумерують, починаючи від ядра: 1, 2, 3, 4, 5, 6, 7 (іноді їх позначать латинськими літерами відповідно К, L. М, N. О, Р, Q). Максимальна кількість енергетичних рівнів елемента чисельно дорівнює номеру періоду, в якому він розташований.
Ціле число n. позначає номер рівня, називають головним квантовим числом. Воно характеризує енергію електронів, що займають даний енергетичний рівень. Найменшу енергію мають електрони першого енергетичного рівня, найближчого до ядра. У порівнянні з електронами першого рівня електрони наступних рівнів характеризуються великим запасом енергії. Відповідно саме електрони зовнішнього рівня набагато слабкіше пов'язані з ядром.
Максимальна кількість електронів на енергетичному рівні дорівнює подвоєному квадрату номера рівня, тобто:
де N (e -) - кількість електронів,
n - номер рівня (починаючи з ядра), або головне квантове число.
Отже, на першому енергетичному рівні може розміститися не більше 2 електронів, на другому - не більше 8, на третьому - не більш 18, на четвертому - не більше 32.
Максимально заповнений рівень називають завершеним, а електронну оболонку елемента з завершеним зовнішнім енергетичним рівнем - електронною оболонкою благородного газу 2.
Енергетичні рівні складаються з підрівнів. Кожен підрівень також вміщує обмежену кількість електронів. Кількість підрівнів визначається номером енергетичного рівня. Число підрівнів одно головному квантовому числу: перший рівень має один підрівень, другий - два, третій - три, четвертий - чотири підрівні і так далі. Підрівні позначають латинськими буквами 3.
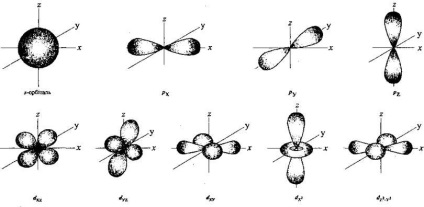
• перший s -подуровень складається з однієї s орбіталі;
• другий р-підрівень складається з трьох p орбіталей;
• третій d -подуровень складається з п'яти d орбіталей;
• четвертий f - підрівень містить сім f - орбіталей.
Орбіталі знаходяться на певних відстанях від ядра, мають певну форму і орієнтацію в просторі. Найпростіша форма - сферична (форма кулі). Її називають s -орбіталлю, а електрони, які на ній розташовані, - s-електронів. Іншу форму має р-орбіталь: це форма об'ємної вісімки або гантелі. Такі орбіталі розташовані в атомі уздовж взаімоперпендікулярних осей просторових координат 0 X. 0 Y і 0 Z. а тому їх позначають рх. ру і р z. У сукупності на трьох p орбіталей максимально може розміститися шість р-електронів (по два на кожній з них). Існують і більш складні форми орбіталей:
1 Спін (в перекладі з англійської - крутитися) характеризує обертання електрона навколо власної осі; одне з квантових чисел (-1/2, +1/2), що описують властивості елементарних частинок. Квантові числа в квантовій механіці - чисельні значення квантових змінних мікрооб'єкта, що характеризують його стан.
2 Ідею стабільності завершеного електронного шару запропонував видатний американський фізико-хімік Джілберт Ньютон Льюїс (1875-1946), хоча сам термін октет (октетное теорія) він ніколи не використовував.
3 Позначення пов'язані з початковими буквами слів, що означають уявлення про можливу форму хмар: s-електронів хмара ймовірно має сферичну форму (фр. Sphere), р - гантелеподібну (фр. Poignees), d - діскоподібну (фр. Disque). За сучасними уявленнями d -облако не є дископодібної, отже такі орбіталі позначають буквами латинського алфавіту: f. g. h.
2.4.1. Заповнення орбіталей електронами
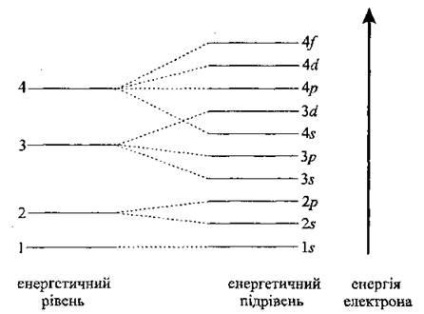
Заповнення електронами орбіталей визначається декількома принципами. Один з них - принцип мінімуму енергії: електрон в атомі займає таке положення, щоб його енергія була мінімальною (правило Клєчковського).
Основний стан атома характеризується мінімальною енергією. А тому електрони заповнюють орбіталі в порядку збільшення їх енергії. Спочатку заповнюється перший енергетичний рівень. Наступний (другий) заповнюється тільки після того, як буде повністю заповнений перший енергетичний рівень. Третій заповнюється після другого. Електрони, які розміщуються в зовнішньому енергетичному рівні, називають зовнішніми, або валентними. Саме вони визначають хімічні властивості елементів.
В межах одного рівня, наприклад другого, спочатку заповнюється s -подуровень, а потім p -подуровень.
Зауважимо, що енергія 3 d -подуровня вище, ніж енергія 4 s -подуровня, а тому спочатку заповнюється 4 s. а тільки потім 3 d -подуровень і т. д. Розподіл енергетичних рівнів і підрівнів в багатоелектронному атомі (в послідовності зростання енергії): 1 s 2 s 2 р 3 s 3р 4 s 3 d 4р 5 s 4 d 5 p 6 s.
Розподіл електронів в атомі по енергетичних рівнях і подуровням зображують у вигляді електронних формул. При складанні електронних формул користуються такими правилами:
1. Під час заповнення одного підрівня електрони розташовуються так, щоб сумарний спин був максимальним (це відповідає стійкому стану атома) (правило Гунда).
2. Спіні неспарених електронів, що знаходяться на різних орбіталях, повинні бути паралельними. Наприклад, якщо на p -подуровне є 3 електрони, то їх розміщують на трьох різних орбіталях рх. ру і р z.
Заповнення електронами рівнів і підрівнів ілюструють електронними формулами і їх графічними варіантами. Наприклад, в першому періоді розміщено тільки два елементи - Водень (Н) і Гелій (Не). У водню єдиний (неспарених) 1 s-електрон на першому рівні, що можна записати так:
Оскільки на першому рівні може бути не більше двох електронів, то у атома Гелія він уже завершений - 2 Не 1 s 2 В атома Гелія на першому енергетичному рівні є два спарені s-електронів з протилежними спинами.
У елементів другого періоду заповнюється другий енергетичний рівень (n = 2). У Літія і Берилію знову починає заповнюватися s -подуровень: 3 Li 1 s 2 2 s 1 (також записують скорочену електронну формулу: 3 Li [He] 2 s 1. або 3 Li. 2 s 1. що ми в подальшому і будемо робити ) 2. 4 Ве [He] 2 s 2. Це теж s-електрон, але енергія їх вище, ніж в 1 s. Вони утворюють великі за розміром орбіталі, розташовані далі від ядра.
У наступних шести елементів, починаючи від Бора і закінчуючи Неоном, заповнюється p -подуровень. Електронні формули цих елементів такі: 5 В [He] 2s 2 2р 1; 6 Сек [He] 2s 2 2 p 2; 7 N [He] 2s 2 2р 3; 8 O [He] 2s 2 2 p 4; 9 F [He] 2s 2 2р 5; 10 Ne [Do Not] 2s 2 2р 6.
На другому енергетичному рівні, як уже вказувалося, може бути не більше 8 електронів. У елементів 3-го періоду починає формуватися третій енергетичний рівень (n = 3), який максимально може містити вже 18 електронів; їх називають s-елементів (11 Na [Ne] 3 s 1; 12 Mg [Ne] 3 s 2) і р-елементами (13 Al [Ne] 3 s 2 3 p 1; 14 Si [Ne] 3 s 2 3 p 2; 15 P [Ne] 3 s 2 3 p 3; 16 S [Ne] 3 s 2 3 p 4; 17 Cl [Ne] 3 s 2 3 p 5; 18 Ar [Ne] 3 s 2 3 p 6 ).
1 Кількість неспарених електронів в атомі вказує на можливі значення валентностей елемента. Отже, Водень має тільки одну валентність - 1.
2 Під виразом [Do Not] передбачають електронну формулу атома останнього з попередніх благородних газів, в даному випадку - Гелія.