- теоретичне обґрунтування експериментальної частини роботи,
- методику експерименту, що включає схему установки,
- таблицю 3.2 спостережень,
- графічні залежності температури від часу, побудовані на міліметрівці,
- розрахунок теплоти хімічної реакції,
- розрахунок відносної і абсолютної похибки вимірювань.
Відносна похибка вимірювань не повинна перевищувати 5%.
Лабораторна робота 9
термометричні титрування
Мета роботи: визначення концентрації речовини на використанні теплоти, що виділяється при хімічних реакціях.
Прилади і реактиви: пробірка, бюретка, термометр Бекмана.
теоретичне обґрунтування
Для визначення концентрації речовини A можна застосовувати термометрична титрування, яке засноване на використанні теплоти, що виділяється (або поглинається) при хімічних реакціях. Для цього підбирають речовину B (титрант), який вступає в що йде до кінця реакцію з речовиною A. До тітруемих розчину доливають поступово титрант. В ході додавання титранту в результаті взаємодії речовин A і B виділяється або поглинається теплота і температура реакційної суміші змінюється до тих пір, поки речовина A НЕ прореагує повністю. Після досягнення стехиометрического співвідношення A і B подальше Прилив титранту не змінює температури реакційної суміші і вона залишається постійною або плавно змінюється за рахунок теплообміну з навколишнім середовищем. На кривій залежності зміни температури реакційної суміші від кількості доданого розчину B з'являється точка перегину, що дозволяє визначити стехиометрическое кількість речовини B.
Термометричні титрування застосовується і тоді, коли інші методи титрування незастосовні. При вдалому підборі титри реагенту метод можна застосовувати для титрування забарвлених, в'язких речовин і систем, що містять смолисті або тверді домішки. Термометричні титрування можна застосовувати для наступних типів реакцій:
1) взаємодія кислот і підстав:
Концентрація титруемого розчину не повинна бути менше 0,05 ... 0,5 н (при низьких концентраціях мало зміна температури) і не перевищувати 1 н, так як змішання концентрованих розчинів кислот і лугів крім теплоти нейтралізації супроводжується виділенням теплоти розведення;
2) реакції, при яких одним з кінцевих продуктів є практично нерозчинний осад:
;
.
Чим менше розчинність осаду, тим вище точність результатів титрування. Твір розчинності вищенаведених гідроксидів становить:
;.
Незначна розчинність цих опадів дозволяє з достатньою точністю (1%) визначити концентрації іонів Li + і Na + в 0,05 ... 0,5 н розчину;
3) реакції, при яких одним з продуктів є розчинна стійке комплексне з'єднання:
Стійкість комплексного з'єднання визначається константою нестійкості:
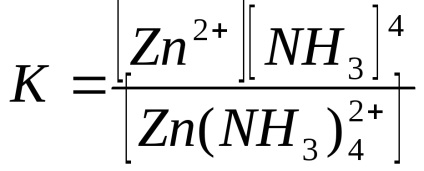
У даній роботі слід визначити концентрацію соляної кислоти за тепловим ефектом реакції нейтралізації.
Налити 20 мл титруемого розчину в пробірку зі скляною оболонкою, закріплену на штативі, опустити в розчин скляну мішалку і термометр Бекмана. Протягом 2 ... 3 хв спостерігати за зміною температури. Швидкість зміни температури не повинна перевищувати 0,02 град / хв. За допомогою звичайного термометра порівняти температуру титруемого розчину і титранту. Якщо відмінність в температурах не перевищує 0,1, титрант вилити в бюретку, закріплену на тому ж штативі, що і пробірка. Кінець бюретки опустити в пробірку таким чином, щоб титрант не попадав на термометр, і доливати його до тітруемих розчину безперервно. Тітруемих розчин весь час розмішувати мішалкою. Показання термометра Бекмана записувати після кожного доданого обсягу титранту. На підставі отриманих даних побудувати графік в координатах температура - обсяг титранту (рис.6).
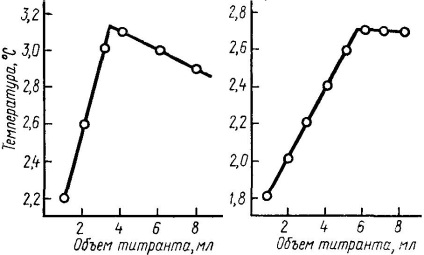
Мал. 3.6. Криві термометрического титрування.
Точку еквівалентності титрування для першого попереднього досвіду визначити за графіком і на підставі отриманих даних встановити умови для проведення трьох точних дослідів, виходячи з таких положень: точка еквівалентності титрування повинна лежати в інтервалі 3 ... 8 мл, так як зміни висоти стовпа титранту в бюреткек і обсягу титруемого розчину зменшують швидкість пріліваніем і дають додатковий злам на кривій, що ускладнює визначення точки еквівалентності. Якщо точка еквівалентності лежить в інтервалі 3 ... 8 мл, концентрації титруемого і титрують розчином залишають без зміни; для інтервалу 0 ... 3 мл слід зменшити концентрацію титранту; для інтервалу 8 мл і більше слід зменшити концентрацію титруемого розчину. При остаточному титрування записувати свідчення термометра Бекмана після пріліваніем кожних 0,5 мл розчину. Розбіжність між результатами окремих дослідів для визначення точки еквівалентності не повинно перевищувати 0,2 мл.