1.3. Хімічні властивості
1.4. оптична ізомерія
2.2. Пептидний зв'язок
Визначення: Органічні сполуки містять в молекулі карбоксильну та аміногрупи, називаютсяамінокіслотамі. Із залишків амінокислот побудовані білки - основний матеріал, з якого складаються об'єкти живої природи. Тому амінокислоти мають величезне значення.
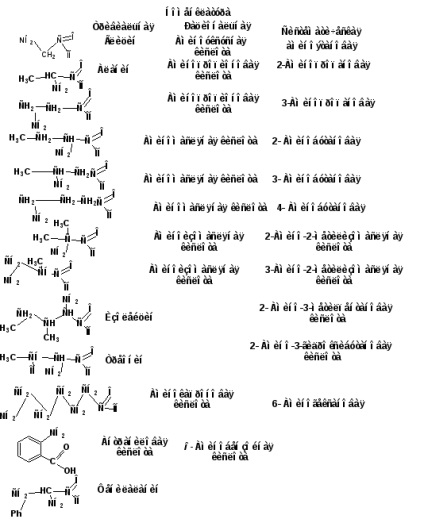
1.1. Класифікація, номенклатура, ізомерія.
26 α-амінокислот, з яких побудовані білки, мають власні назви. Наприклад: гліцин, аланін, валін, серин і т.д. Раціональна номенклатура будується по тривіальним назвою карбонової кислоти в префікс ставиться «аміно» і буквою грецького алфавіту позначається положення гідроксигрупи. За систематичною номенклатурою локантом позначається положення аміногрупи. Карбоксильная група завжди займає перше положення. Назва будується по вуглеводню з добавкою префікса «аміно» і суфіксів «ова» або «Діовен».
Відповідний ряд одноосновних амінокислот починається з аміномуравьіной або неповного аміду вугільної кислоти. Потім йде гліцин або амінооцтова, Ці дві кислоти не мають структурних ізомерів. Ізомерія амінокислот пов'язана з положенням аміногрупи і будовою вуглецевого скелета. Тому у наступній карбонової кислоти - пропіонової - молгут бути два ізомери, що розрізняються положенням аміногрупи: α-аміно пропионовая і β- міно пропионовая кислота. Кислота з чотирма вуглецевими атомами може існувати у вигляді п'яти ізомерів. Три відповідають н -масляний кислоті і два ізомасляной кислоті.
Всі природні амінокислоти, крім аминоуксусной, містять асиметричний атом вуглецю. Всі вони відносяться до L-ряду.
1.2. способи отримання
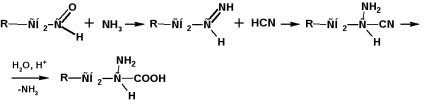
Дією аміаку на α-галоідкарбоновие кислоти:
Отримання за методом Штреккер-Зелінського
За цим методом альдегід обробляють водним розчином суміші ціаністого калію і хлориду амонію:
Приєднання аміаку до α, β-ненасичених кислот:
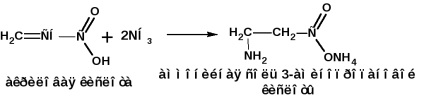
Отримання за методом Родіонова:
Способи отримання інших амінокислот
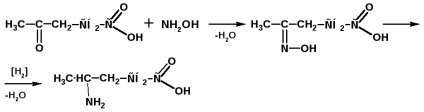
Отримання γ-амінокислоти з левуліновой кислоти:
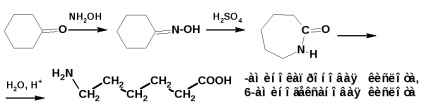
Амінокислоти з більш віддаленими одна від одної функціональними групами отримують перегрупуванням Бекмана. Наприклад, отримання капролактаму та ω-амінокислоти (ω-капронової кислоти):
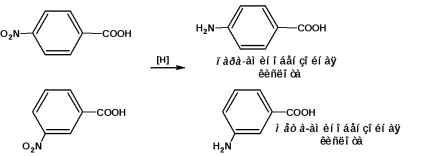
пара - і мета -Амінобейзойние кислоти отримують відновленням відповідних нітробензойної кислот:
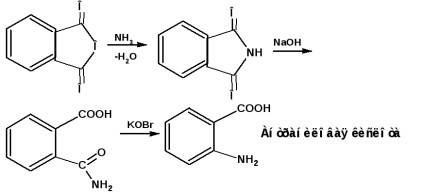
орто -ізомер. так звану антранілову кислоту отримують з фталевого ангідриду, через фталімід дією гіпоброміту:
1.3. Хімічні властивості
Амінокислоти - безбарвні кристалічні речовини з високими температурами плавлення, які мало відрізняються для різних амінокислот і тому не характерні. Плавлення супроводжується розкладанням векщества. Плавлення з розкладанням характерно для солей. Будучи солями амінокислоти добре розчинні у воді. Водний розчин амінокислот має нейтральну реакцію, що також характерно для солей. Амінокислоти являють собою так звані внутрішні солі (біполярні іони):
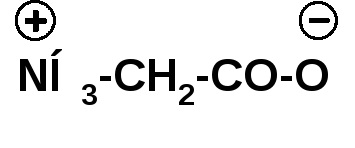
Такий іон в кислому середовищі поводить себе як катіон, так як пригнічується дисоціація карбоксильної групи, а в лужному середовищі амінокислота поводиться як аніон:
Значення рН при якому досягається максимальна концентрація біполярного іона - називається ізоелектричної точкою.
Подібно до інших сполук із змішаними функціями, амінокислоти проявляють властивості кислот і амінів.
Амінокислоти утворюють солі з основами. Солі α-амінокислот з важкими металами можуть мати комплексний характер:
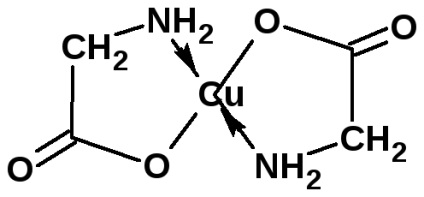
сіль має інтенсивно синє окрашівааніе.
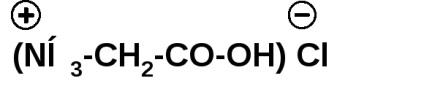
Амінокислоти утворюють солі з неорганічними кислотами:
Подібно до інших кислот, амінокислоти утворюють складні ефіри, хлорангідриди, аміди і т.д:
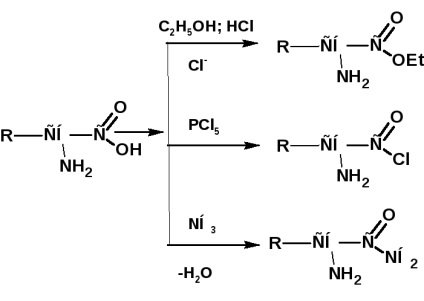
При дії азотистої кислоти амінокислоти утворюють гідроксикислоти:
Аміногрупа в амінокислотах легко ацилуючий при дії ангідридів і хлорангидридов кислот:
При алкилировании аміногрупи виходять вторинні і третинні амінокислоти. В надлишку галоидного алкила утворюються четирехзамещенниеаммонійние підстави. Внутрішні солі таких підстав називаються бетаїн:
Поведінка α, β і γ-амінокислот при нагріванні:
α-амінокислоти міжмолекулярної утворюють циклічні аміди - дікетопіперазін:
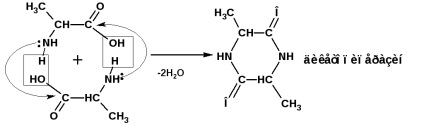
β-амінокислоти при нагріванні відщеплюють молекулу аміаку з утворенням α, β-ненасичених кислот (амонійна сіль):
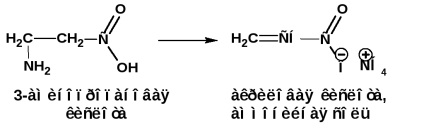
γ і δ-амінокислоти при нагріванні відщеплюють воду і утворюють внутрішньо-молекулярні циклічні аміди - лактами:
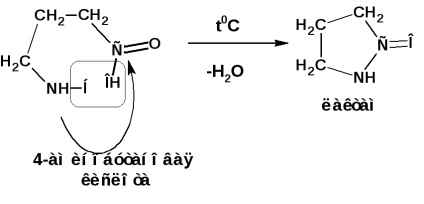
Визначення. Білки - це складні високомолекулярні органічні сполуки. побудовані із залишків амінокислот, з'єднаних між собою амідних зв'язками.
Білки поділяються на протеїни (прості білки), до складу яких входять тільки залишки амінокислот і протеїди (складні білки). Це білки побудовані не тільки з амінокислот, але і з інших речовин: сахаридов або залишків фосфорної кислоти і нуклеїнові кислоти.
Протеїни класифікуються за трьома групами.
1. За розчинності у воді:
Альбуміни - розчинні у воді і розведених розчинах солей.
Глобуліни - мало розчинні у воді і розчинні в розведених розчинах солей.
Проламіни - нерозчинні у воді і розчинні у водному спирті.
Глютеліни - нерозчинні у воді, в розбавлених розчинах солей і водному спирті, розчинні в розчинах кислот і лугів.
Склеропротеіни - нерозчинні у воді, в розбавлених розчинах солей, водному спирті і в розчинах кислот і лугів.
2. Протеїди класифікуються по продуктах гідролізу:
Нуклеопротеїди - гідролізуються на протеїни і нуклеїнові кислоти.
Фосфопротеіди - гідролізуються на протеїни і фосфорну кислоту.
Глюкопротеіди - гідролізуються на протеїни і вуглевод.
Хромопротеїди - гідролізуються на протеїни і фарбувальні речовини.
3. Всі білки класифікуються за функціями в організмі:
Білки, що управляють метаболізмом.
Як і амінокислоти, білки мають амфотерним характером і ізоелектричної точкою. Положення ізоелектричної точки для білків може коливатися в широких межах від кислої до лужної.
Всі білки оптично активні. Більшість з них володіє лівим обертанням.
Існує ряд якісних кольорових реакцій на білки:
1. Ксантопротеиновая з азотною кислотою. Білки оброблені азотною кислотою дають жовте забарвлення.
2. Біуретова з солями міді в присутності лугу. Білки дають фіолетове забарвлення за рахунок утворення комплексної солі.
3. Реакція Миллона. З розчином нітрату ртуті в азотної кислоті білки дають червоне забарвлення.
4. сульфгідрильної. При нагріванні білків з розчином плюмбіта натрію виділяється чорний осад сульфіду свинцю.
Білки побудовані із залишків 26 амінокислот. Амінокислоти поділяються на замінні, які можуть бути синтезовані організмом і незамінні, які людським організмом не синтезуються. Наприклад, ізолейцин і треонін.
Залишки амінокислот пов'язані в білкової молекулі амідними зв'язками. Амідна зв'язок в білках називається пептидного зв'язком:
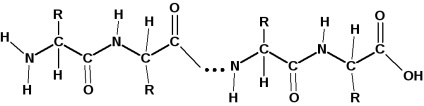
Карбоксильная група однієї молекули амінокислоти утворює амід, взаємодіючи з аминогруппой сусідній молекули амінокислоти. Окремі пептидні ланки:
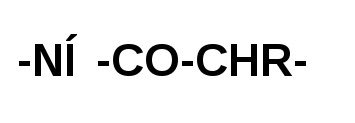
відрізняються один від одного тільки радикалами «R» при α-вуглецевому атомі.
Сполуки, що містять кілька амінокислотних залишків, називаються пептидами. З'єднання з великою кількістю пептидних ланок називаються поліпептидами.
При дослідженні поліпептидів в першу чергу з'ясовують з яких амінокислот побудована макромолекула, а також яка амінокислота є N-кінцевий (вільна аміногрупа), а яка є С-кінцевий (вільна корбоксільная група).
Білки остачі гідролізуються в амінокислоти концентрованою соляною кислотою або 2% соляною кислотою при нагріванні і при підвищеному тиску. Гідроліз білків можна провести під дією лугу. Вибір реагенту залежить від того, які конкретно амінокислоти необхідно отримати з молекули білка.
Визначення N-кінцевої амінокислоти
Проводять з використанням 2,4-дінітрофторбензола:
При взаємодії 2,4-дінітрофторбензола з пептидом фтор нуклеофільність заміщається на кінцеву аміногрупу. Потім пептид піддають гідролізу. Продукт взаємодії кінцевої амінокислоти з 2,4-дінітрофторбензолом виділяють і кислоту ідентифікують. У тих випадках, коли 2,4-дінітрофторбензол непридатний - використовують фенілізотіоціанат.
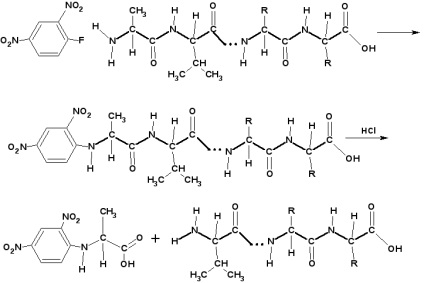
Визначення С-кінцевої амінокислоти:
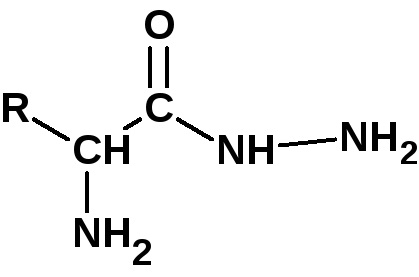
Для визначення С-кінцевої амінокислоти (з вільним гідроксилом) пептид нагрівають з гідразином при 100 0 С кілька годин. При цьому всі амінокислоти, крім кінцевий, утворюють гідразиди:
Амінокислоту, що не образовавшую гідразид, виділяють і ідентифікують.
Простіший метод полягає в застосуванні ферменту карбоксипептидази, який розщеплює пептидний зв'язок тільки С-кінцевої амінокислоти. Її можна виділити і ідентифікувати.
Побудова поліпептидного ланцюга проводять за методом Е. Фішер. Метод заснований на застосуванні хлорангидридов α-галогензамещеннх кислот. Наприклад, треба отримати ланцюга:
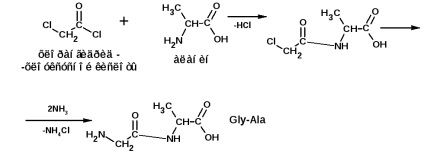
і аланінгліцінвалін (Ala-Gly-Val):
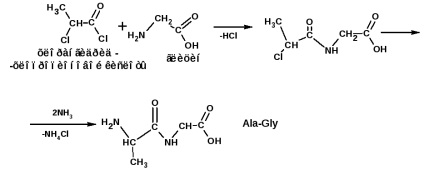
Послідовність амінокислот, ковалентно пов'язаних між собою в поліпептиді, становить так звану первинну структуру білка. Але власне поліпептид білком ще не є. Пептиди здатні до функціонування. Виконувати будь-які функції в організмі здатні більш складні системи побудовані з декількох поліпептидних ланцюгів, певним чином пов'язаних один з одним. Надмолекулярних структури, сформовані полопептіднимі ланцюгами, характеризуються вторинної, третинної і четвертинної структурою білка.
Вторинна структура обумовлена водневими зв'язками між пептидно не пов'язаними киснем карбонільної групи і воднем аминной групи. Якщо карбоніл і аминная група належать різним поліпептидним ланцюгах, то така вторинна структура називається β-структурою. Якщо карбоніл і аминная група належать одній і тій же поліпептидного ланцюга, то така вторинна структура називається α-структура. Наслідком α-структури є існування поліпептидного ланцюга в формі спіралі навитої на циллиндр. Довжина одного залишку 1,5 А 0. довжина кроку спіралі 5,4 А 0. Водневі зв'язку α-спіралі утворюються між кожною першою і четвертою амінокислотою.
Третинна структура білка формується в результаті складання або свіванія декількох α-спіралей. При цьому спіралі утримуються одна біля одної за рахунок утворення водневих зв'язків, утворених бічними аміно-, гідрокси- та карбоксильними групами, а також дисульфідними зв'язками і електростатично.
Четвертичная структура формується як агрегат декількох поліпептидних ланцюгів, що мають вторинну і третинну структури. Поліпептидні ланцюги утримуються в четвертичной структурі тими ж силами, що і в третинної структурі.
Руйнування первинної вторинної, третинної і четвертинної структури білка називається денатурацією. Денатурація може бути викликана термічно (нагрівання), хімічно, механічно і т. Д. При цьому денатурація буває оборотною і безповоротною. Незворотною є денатурація, пов'язана з руйнуванням первинної і вторинної структури. Після їх руйнування білок мимоволі не відновлюється. Наприклад, гідроліз білків або варіння яєць або м'яса, збивання яєчного білка. Денатурація третинної і четвертинної структури є оборотною. Після їх руйнування білки можуть мимовільно відновлюватися з поверненням біологічних функцій. Наприклад, накручування волосся на бігуді (термічна денатурація) або хімічна завивка.