Кісткова тканина - це особливий вид сполучної тканини, що включає компоненти органічної і неорганічної природи, що виконує функцію депо Са (99%). Кісткова тканина має особливості будови, які не зустрічаються в інших видах сполучної тканини. Основні особливості кістки - твердість, пружність, механічна міцність.
Складається з клітин і кісткового матриксу (міжклітинної речовини). Кістковий матрикс становить 50% сухого "ваги і складається з неорганічної (50%) і органічної (25%) частин і Н2 О (25%).
Неорганічна частина в значній кількості містить Са (25%) і Р (50%), що утворюють кристали гідроксиапатиту, а також інші компоненти: бікарбонати, цитрати, солі Mg 2+. K +. Na + і ін.
Органічна частина утворена колагеном, неколлагенових білками, глікозаміногліканами (хондроитинсульфат, кератан-сульфат).
Власне кісткові неколагенові білки представлені сіалопротеін, протеогликанами, Фосфопротеіни і складним білком, що містить вуглеводний компонент і ортофосфат. Від правильного набору матриксних білків, особливостей будови, а також специфічного амінокислотного складу залежить відкладення гідроксиапатиту, створюючи необхідну концентрацію Са для процесу мінералізації.
Сіалопротеін мають молекулярну масу 70000. 50% - це вуглеводи, 12% -сіаловая кислота. Більшість вуглеводів - це олігосахариди (фруктоза, галактоза, глюкоза, маноза, пентоза, галактозамин). До 30% серина і інші амінокислоти: аспарагінова і глутамінова, ковалентно пов'язані з фосфатом. Присутність цього білка забезпечує:
Неколлагенових білків у кістковій тканині близько 200, вони складають 3-5% від її маси або 15-17% від маси її деминерализованного і висушеного позаклітинного органічного матриксу. Всі вони беруть участь в процесах забезпечення гистогенеза, самопідтримки, імунологічні властивості протягом усього життя і репарації кісткової тканини.
Кальцій-зв'язуючі білки кісткової тканини.
Остеонектін - молекулярна маса 32 кДа. Він має кальцій-зв'язуючі ділянки, утворені сіалові кислоти і ортофосфат, що надають можливість взаємодії з колагеном і вибірково з гідроксиапатиту. Він підтримує в присутності колагену осадження Са і РО4 3-.
Остеопонтін - молярна маса 41,5 кДа, багатий дікарбоновими амінокислотами і фосфосерин, 30 залишків моносахаридів, 10 залишків сіалових кислот. Він здатний фіксувати остеобласти в ділянках фізіологічного і репаративного кісткоутворення. Його синтез різко зростає під час трансформації вірусів.
Остеокал'цін - це гла-якому протеїн.
Справа в тому, що кісткова, як і інші тканини, містить білки, які піддаються посттрансляційної модифікації за допомогою вітамін К-залежних ферментів, в результаті чого утворюються залишки у-карбоксілглутаміновой кислоти (gla). Модифікована таким чином амінокислота надає білків здатність зв'язувати Са 2+ за допомогою розташованих по сусідству карбоксильних груп. Молекула цього білка складається з 49 амінокислотних залишків (в 17-му, 21-му 24-ом положеннях - залишки у-карбоксілглутаміновой кислоти). Роль їх - пов'язувати кристали гідроксиапатиту і тим самим сприяти їх накопиченню в тканини.
Синтез остеокальцину залежить не тільки від вітаміну К, але і D, що підкреслює його зв'язок з процесом мінералізації.
gla-протеїн-матриксу (молекулярна маса - 15000). Він зберігається в матриксі кістки після демінералізації, на відміну від остеокальцину, який легко екстрагується в цей період. Залишків у-карбоксілглутаміновой кислоти до шести. Він пов'язує мінеральні кристали і легко розчинний у воді кістковий морфогенетичний білок, доставляючи його до клітин-мішеней.
Протеїн-S- синтезується в печінці, участь в метаболізмі кісткової тканини доводиться фактом зміни скелета у пацієнтів з дефіцитом цього білка. Але, ще не з'ясовано, яким типом клітин кісткової тканини він синтезується.
Протеоглікани - клас складних з'єднань, що складаються з різних білків, що містять олігосахариди, пов'язані з глікозаміногліканами (хондроитинсульфат, дерматансульфат, кератансульфатів, гепарин). Серед них розрізняють:
Великий хондроітінсульфатсодержащій протеогликан. Передбачається, що цей протеогликан «захоплює простір», яке повинно стати кісткою, завдяки великому вмісту сульфату, в гидротірованний стані здатний займати значний обсяг простору.
Декорін і біглікан дуже подібні за будовою, відповідно мають один або два глікозаміноглікану, білкова частина містить 24 амінокислотних залишку, багатих лейцином. Незважаючи на біохімічне схожість, ці білки відрізняються по локалізації. Локалізація більш поширеного декоріна збігається з розташуванням колагену, що відповідає його функції «обробляти» молекули колагену і регулювати діаметр фібрил. Біглікан зберігається в матриксі.
До теперішнього часу виділено багато інших типів протеогліканів, але це в основному білки клітинної поверхні, роль яких мало вивчена.
На частку альбуміну припадає більша частина неколлагенових білків. За імунологічних властивостях ідентичний сироваткового.
Вуглеводи відіграють величезну роль в життєдіяльності кісткової тканини, в процесах її освіти. На частку глікогену доводиться 50-80мкг на 1г вологої тканини. Присутність глікогену - необхідна умова процесу мінералізації, він концентрується головним чином на місці майбутнього центру мінералізації. У кісткової тканини з великою інтенсивністю протікають процеси гліколізу і пентозофосфатного шляху.
Ліпіди відіграють важливу роль в процесі мінералізації і транспорту іонів через мембрани. Переважають полярні ліпіди: фосфатидилхолін,
фосфатіділсерін, фосфатіділетаноламін. Всього 0,61% ліпідів на суху масу тканини.
1. розчинної - бере участь в циклі трикарбонових кислот;
2. нерозчинної - неактивною, що входить до складу мінерального компонента кісткової тканини.
У кісткової тканини активно переважають метаболічні процеси. Характерна особливість - аеробний гліколіз. Споживання глюкози як в аеробних, так і в анаеробних умовах остеогенними клітинами значно більше, ніж клітинами печінки, м'язів і інших органів.
Структура і функції кісткової тканини підтримуються специфічними ферментами, які синтезують і розщеплюють макромолекулярні компоненти органічного матриксу кістки і ферментами загальних метаболічних шляхів, що постачають кісткові клітки енергією. Ферментам належить важлива роль в процесах мінералізації та резорбції кістки.
Слід зазначити специфічну локалізацію ферментів. У остеокластах проявляється більш висока активність дегідрогеназ, кислої фосфатази, амінопептидази, в порівнянні з іншими клітинами. У той же час остеокласти не містять лужноїфосфатази. Висока активність аденілатциклази, піруваткінази, фосфотрансферази в зонах росту, де протікають процеси кальцифікації.
Кисла фосфатаза зосереджена в остеокластах. Вона безпосередньо бере участь в розробці кістки, здійснюючи розщеплення органічних ефірів фосфорної кислоти зі звільненням фосфатних іонів. Таким чином, кисла фосфатаза - лізосомних ферментів і її головна функція полягає в катаболизме, тоді як лужна - бере участь в процесах мінералізації.
Основний білок кісткової тканини - колаген, який міститься в кількості 15% - в компактній речовині, 24% - в губчастої речовини.
Кістковий колаген - колаген I типу - в ньому більше, ніж в інших видах колагену, міститься оксипролина, лізину і оксилізину, негативно заряджених амінокислот, з залишками серину пов'язано багато фосфату, тому кістковий колаген - це фосфопротеин. Завдяки своїм особливостям кістковий колаген бере активну участь в мінералізації кісткової тканини.
У процесі життєдіяльності кісткової тканини між її компонентами і неорганічними іонами плазми крові постійно здійснюється обмін.
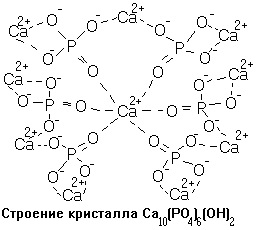
Структура решітки неорганічних кристалів кістки відповідає структурі кристалів гідроксиапатиту Ca10 (PO4) 6 (OH) 2 - це частина мінеральної фази кістки, інша частина представлена аморфним фосфатом кальцію. Він являє щільну некристалічні субстанцію у вигляді аморфних гранул, що мають вид овалів або кіл, діаметром 5,0-20,0 нм. Є важливим компонентом кісткової тканини, і його присутність не залежить від анатомічної будови кістки, але піддається значним коливанням в залежності від віку. Ця фаза переважає в ранньому віці, в зрілої ж кістки переважним стає кристалічний гідроксиапатит. Освіта кісткової солі відбивається загальним рівнянням:
Розчиненню кісткової тканини сприяє локальне підвищення кислотності середовища. При невеликому підвищенні вмісту протонів водню кістка починає розчинятися, віддаючи спочатку катіони кальцію:
При більшій кислотності середовища відбувається повний її розпад:
Гідроліз аморфного кальційфосфата забезпечує постійну концентрацію кальцію в інтерстиціальної рідини кісткової тканини.
В даний час відомо більше 30 мікроелементів: Сі, Sr, Zn, Ba, Al, Be, Si, F і інші. Вони необхідні для життєдіяльності отеогенних клітин в процесі оссификации і декальцінаціі.
Звапніння кісткової тканини і її декальцінаціі знаходяться в тісній залежності від вмісту мікроелементів. Так, Sr і V сприяють звапнінню, a Zn і Ва беруть участь в регуляції процесу декальцінаціі. Mg активує ряд ферментів, зокрема, лужну фосфатазу, що бере участь в процесі мінералізації.
На особливу увагу заслуговує Sr. Його хімічні властивості близькі до Са. Sr конкурує з Са за місце в кристалічній решітці, однак Sr утримується в меншій мірі, ніж Са, в тому випадку, якщо в раціоні переважає Са. При дефіциті ж Са в раціоні Sr поглинається організмом в значно більших кількостях, ніж в нормі. Тривале надходження надлишкових кількостей Sr веде до заміщення їм іонів Са в кристалічній решітці гідроксиапатиту, в результаті чого кістки демінералізуєтся і деформуються.
У зрілому організмі процеси мінералізації та резорбція кістки знаходяться в стані динамічної рівноваги. Мінералізація - це формування кристалічних структур мінеральних солей кісткової тканини. Активну участь в мінералізації приймають остеобласти. Для мінералізації потрібно багато енергії (в формі АТФ), регульованою багатьма факторами, включаючи ферменти, гормони, вітаміни.
Рішучий поворот у вивченні мінералізації почався з 1923р. незабаром після відкриття в кістковій тканині ферменту лужної фосфатази. Англійська біохімік Р.Робінсон висловив пропозицію, що фосфорнокислий кальцій відкладається там, де діє цей фермент. Однак лужна фосфатаза міститься в багатьох тканинах, що не піддаються мінералізації, і для того, щоб відбулося звапніння необхідні інші фактори.
Пізніше було доведено участь багатьох чинників: глікогену, ферментів гіколіза, АТФ, ЦТК, глікозаміногліканів.
Для наведених всіх теорій і деяких експериментальних даних загальним є уявлення про провідну роль ферментів, відщеплюється неорганічний фосфат від органічного субстрату. Концентрація фосфату в ділянках функціонування цих ферментів підвищується, досягаючи рівня, при якому починається його мимовільне осадження, що приводить до кристалізації. •
Подальші дослідження дозволили припустити, що процес кальцифікації складається в очаговом освіту центрів кристалізації гідроксиапатиту з розчинів Р і Са під дією колагенових волокон, в яких необхідне специфічне взаємне розташування реакційноздатних груп бічних амінокислотних ланцюгів, здатних служити центрами кристалізації.
Важливу роль в мінералізації виконують глікозаміноглікани, зокрема хондроитинсульфат, які володіють підвищеною спорідненістю до іонів Са і Р. підтвердженням служать експериментальні дані, що демонструють, що глікозаміноглікани інтенсивно секретуються остеобластами в зоні мінералізації, а потім піддаються дії лізосомальних ферментів, утворюючи високоактивні іони.
Біохімічну основу нуклеации первинних зародкових кристалів становить реакція утворення комплексу між колагеном, АТФ, Са і хондроітінсульфата. До факторів, які контролюють крісталлообразованія на волокнах колагену відноситься також пирофосфат, який пригнічує мінералізацію. Доведено також роль в цьому процесі фосфоліпідів, без яких органічний матрикс кісткової тканини втрачає здатність обизвествляется.
Вікові зміни кісткової тканини і основна патологія.
У процесі онтогенетичного розвитку кісткова тканина зазнає виражені зміни структурно-морфологічного і біохімічного характеру. У ній відбувається закономірне зниження вмісту органічних компонентів і наростання мінеральних. Ці зміни тісно пов'язані з обміном мікроелементів. Відбувається накопичення Sr, Pb, Si, A1, а концентрація Сі зменшується, інтенсивність метаболізму фосфору і кальцій зменшується в десятки разів.
Один з провідних вікових змін кісткової системи - розвиток остеопорозу - прогресуюче системне захворювання скелета, що характеризується зниженням маси кістки, порушенням структури кісткової тканини, що приводить до збільшення крихкості кістки і ризику переломів.
-порушення менструального статусу (тривала вторинна аменорея, передчасна менопауза - до 45 років, пізній початок менструацій);
-ендокринні хвороби (первинний гіперпаратиреоз, тиреотоксикоз, цукровий діабет, синдром Кушинга);
-хвороби крові (множинна мієлома, системний масто-
цитоз, лімфома, лейкоз);
-запальні ревматичні захворювання (ревматоїдний артрит, дерматоміозит, системний червоний вовчак);
-захворювання шлунково-кишкового тракту (порушення всмоктування, хвороба Крона, хронічні захворювання печінки);
-хронічна ниркова недостатність;
-хронічні неврологічні захворювання.
I. постменопаузного остеопороз (вимагає спостереження протягом 15 років з початку
менопаузи). Відбувається розрідження кісткових балок, збільшується частота
переломів хребців і інших кісток.
П. Сеніл'ний остеопороз - характерний для чоловіків старше 70 років.
III. Вторинний остеопороз - на тлі глюкокортикоїдної терапії синдрому
Кушинга, синдрому мальасорбціі, порушення харчування, тривалої
Попередити остеопороз легше, ніж лікувати. Медикаментозні засоби (кальцитонін, естрогени, кальцій, вітамін D) здатні лише уповільнити швидкість втрати кістки, але, як правило, малоефективні для відновлення вже втраченої кісткової маси.
Естрогени - важливий засіб профілактики з настанням менопаузи у жінок
Са - хворим з остеопорозом показано 1000-1500 мг в день (з їжею надходить близько 500 мг Са).