Вільні і сидячі рибосоми: потрапляння білків в ЕРС Правити
«Вільні» і «сидячі» рибосоми Правити
Котрансляціонний транспорт в ЕПР Правити
Транспорт білків в ЕПР здійснюється в міру їх синтезу, так як рибосоми, що синтезують білки з сигнальної послідовністю для ЕПР, «сідають» на спеціальні транслокаціонние комплекси на мембрані ЕПР.
Сигнальна послідовність для ЕПР включає зазвичай 5-10 переважно гідрофобних амінокислот і розташована на N-кінці білка. В її віддаленому від кінця частині є консенсусна послідовність, впізнавана специфічної протеазой. Ця сигнальна послідовність розпізнається спеціальним комплексом - «впізнали сигнал часткою» (signal-recognition particle, SRP). До складу SRP входить шість білків і коротка молекула РНК.
Одна ділянка SRP пов'язує сигнальну послідовність, а інший зв'язується з рибосомою і блокує трансляцію. Окремий домен SRP відповідає за зв'язування з SRP-рецептором на мембрані ЕПР.
Разом з SRP рибосома переміщається до ЕПР і зв'язується з рецептором SRP (інтегральним білком) на цитозольних стороні мембрани ЕПР. Цей комплекс (рибосома - SRP - рецептор SRP) зв'язується з часом - транслокатора білка на мембрані ЕПР. Зазвичай з мРНК пов'язані кілька рибосом, і на мембрані ЕПР сидять полірібосоми, причому кожна рибосома приєднана до своєї порі. Дійшовши до 3'-кінця мРНК, рибосома повертається в цитоплазму, проте мРНК утримується у мембрани ЕПР за рахунок того, що нові рибосоми, в'язані з SRP, приєднуються до її 5'-кінця.
Після зв'язування з транслокатора комплекс SRP - рецептор SRP відділяється від рибосоми, і це призводить до відновлення трансляції. Зараз доведено, що білок у міру трансляції проникає в ЕПР через водний канал транслокатора, що має ворітної механізм і сформований у еукаріот чотирма субодиницями комплексу Sec61 (гомологічні білки є і на мембранах бактеріальних клітин).
Після відновлення трансляції гідрофобну ділянку сигнальної послідовності залишається пов'язаний з транслокатора, а знову синтезується білок у вигляді петлі проштовхується всередину ЕПР. Цей процес не вимагає додаткових витрат енергі АТФ. Після того, як С-кінець білка відділяється від рибосоми і виявляється всередині ЕПР, протеаза сигнального пептиду відрізає його від білка. Білок всередині ЕПР згортається, набуваючи нормальну конформацію, а сигнальний пептид через що відкрився в транслокатора бічний канал переміщається в ліпідний бішар мембрани ЕПР, де швидко руйнується протеазами.
Що потрапив в ЕПР білок залишається в цій органелле, якщо має спеціальну «утримує в ЕПР» (ER-retaining) послідовність з чотирьох амінокислот на С-кінці. Деякі з залишаються в ЕПР білків відіграють важливу роль в згортанні і посттрансляционной модифікації проходять через ЕПР білків. Так, фермент дисульфид-ізомерази каталізує окислення вільних SH-груп цистеїну і освіту дисульфідних зв'язків, в білок-шаперон BiP перешкоджає неправильного згортання і аггрегации білків до утворення ними четвертинних структур, а також сприяє утриманню пов'язаних з ним білків в ЕПР.
Вбудовування білків в мембрани ЕПР Правити
Схожий, але більш складний механізм забезпечує котрансляціонное вбудовування трансмембранних білків в мембрану ЕПР.
Посттрансляційних транспорт в ЕПР Правити
Існує також посттранляціонний транспорт білків в ЕПР (найбільш простий у дріжджів), при якому повністю синтезований білок зв'язується в цитоплазмі з шаперонами, а потім переноситься в ЕПР через транслокатора за участю шаперонов сімейства Hsp70. Цей вид транспорту є АТФ-залежним. Для транспорту пептидів (довжиною переважно в 8-16 амінокислот) з цитозолю в ЕПР для подальшої їх презентації в комплексі з молекулами MHC-I існує спеціальний транслокатора - TAP-білок.
Транспорт білків з ЕРС в апарат Гольджі Правити
Білки надходять з ЕПР в АГ всередині облямованих мембранних бульбашок, оболонка яких утворюється з білка COP-II. Все правильно згорнуті білки потрапляють в такі бульбашки «за замовчуванням» і переміщаються в АГ, а потім деякі з них повертаються в ЕПР. Однак білки зі спеціальними сигнальними знаками концентруються в транспортних бульбашках, а білки без таких міток потрапляють туди в невеликій кількості. Відокремилися від ЕПР бульбашки, втративши оболонок, зливаються в трубчасто-везикулярне кластери, які за допомогою моторних білків переміщуються по микротрубочкам до АГ. Від цих кластерів (як і від цис-Гольджі) відокремлюються бульбашки, одягнені білком COP-I, що забезпечують зворотний транспорт резидентних білків в ЕПР. Повернення білків в ЕПР забезпечується короткою сигнальної послідовністю на їх С-кінці, яка зв'язується або безпосередньо з COP-I (для мембранних білків), або зі специфічним рецептором, взаємодіє з COP-I (для розчинних білків). Позбавлені цих послідовностей білки переважно залишаються в АГ.
Усередині бульбашок білки поступово переміщуються з цис-Гольджі в транс-Гольджі. У міру переміщення білків анутрі АГ ферменти глікозілтрансферази здійснюють модифікацію їх олігосахаридних «міток». За допомогою подібних ферментів в АГ відбувається синтез глікопротеїдів - муцинов і протеогліканів.
Основна функція апарату Гольджі - сортування білків Правити
Транспорт білків в лізосоми Правити
Транспорт білків з АГ в лізосоми Правити
Мембранні білки і травні ферменти лізосом надходять з транс-Гольджі в складі облямованих клатріном бульбашок в ранню ендосом, а звідти - в лізосоми. Для попадання лізосомальнихферментів (кислих гідролаз) в лізосоми на них повинна прісутсвоввать спеціальна мітка - залишки манозу-6-фосфату на кінцях олігосахаридних ланцюгів. Ця мітка наноситься в два етапи. Спершу в цис-Гольджі фермент N-ацетілглюкозамінфосфотрансфераза приєднує до олігосахаридів залишки N-ацетілглюкозамінфосфата, а потім в транс-Гольджі другий фермент відщеплює N-ацетилглюкозамин. Мітка наноситься на ті білки, які мають специфічні риси третинної структури - «сигнальний горбок» (signal patch). Потім манозу-6-фосфати орієнтуються специфічних мембранним рецептором, до якого приєднуються гідролази. У ендосомамі при зниженні рН гідролази відокремлюються від рецепторів, які в складі спеціальних бульбашок доставляються назад а АГ.
Мутації гена N-ацетілглюкозамінфосфотрансферази призводять до розвитку важкої форми мукополисахаридоза - I-клітинної хвороби, при якій всі ферменти лізосом секретируются в позаклітинне середовище.
Транспорт білків із зовнішнього середовища в лізосоми Правити
Навіть в нормі частина лізосомальнихферментів виділяється з клітини, а частина мембранних білків лізосом потрапляє на її зовнішню мембрану. З позаклітинного середовища лізосомальніферменти можуть поглинатися шляхом ендоцитозу і доставлятися в лізосоми (див. [2]).
Транспорт білків з цитоплазми в лізосоми Правити
Крім везикулярного транспорту з АГ, існує й інший шлях транспорту білків в лізосоми. Так, при шаперон-опосередкованої аутофагії відбувається спрямований транспорт частково денатурованого білків з цитоплазми крізь мембрану лізосоми в її порожнину, де вони перетравлюються. Цей тип аутофагії, описаний тільки для ссавців, індукується стресом. Вона відбувається за участю цитоплазматичних білків-шаперонов сімейства hsр-70, допоміжних білків і LAMP-2, який служить мембранним рецептором комплексу шаперона і білка, що підлягає транспорту в лизосому. У антиген-презентірующих клітинах (наприклад, в дендритних клітинах) транспорт пептидів, презентіруемих в комплексі з MHC-II, може відбуватися прямо в лізосоми за допомогою білка-транслокатора TAPL.
Транспорт білків в клітинне ядро і з ядра Правити
В ядро білки потрапляють через ядерні пори. Через ядерну пору може одночасно транспортуватися до 500 макромолекул в обох напрямках. Білки (пептиди) з молекулярною масою до 5.000 дальтон вільно дифундують через ядерні пори (так що їх концентрація в цитоплазмі і в ядрі однакова). Шляхом пасивного транспорту (дифузії) через пори можуть проникати білки з молекулярною масою до 60.000 дальтон.
З більших білків в ядро потрапляють тільки володіють сигнальної послідовністю для ядра (це один або два коротких ділянки білка, багатих залишками позитивно заряджених амінокислот - аргініну або лізину). З цією послідовністю зв'язуються спеціальні білки - рецептори імпорту в ядро (іноді за допомогою додаткових адаптерних білків). Рецептори імпорту в ядро зв'язуються також з компонентами кремезних пір. Енергію для транспорту забезпечує гідроліз ГТФ, здійснюваний малими мономірними ГТФ-азами - Ran-білками. У цитоплазмі Ran-білок знаходиться у зв'язаному з ГДФ вигляді, так як в цитоплазмі локалізовані Ran-GAP білки (білки-активатори ГТФ-азной активності Ran), а в ядрі Ran-білок знаходиться у зв'язаному з ГТФ вигляді, так як в ядрі локалізована білок, що забезпечує обмін ГДФ на ГТФ. Ran-ГТФ, зв'язуючись на внутрішній стороні ядреной пори з «навантаженим» рецептором імпорту в ядро, забезпечує його проходження всередину ядра і розвантаження. Потім рецептор з приєднаним Ran-ГТФ виходить в цитоплазму, де GAP-білок викликає гідроліз ГТФ і відділення Ran-ГДФ від рецептора імпорту в ядро.
Аналогічний механізм забезпечує експорт білків з ядра, тільки ці білки повинні мати інший сигнальної послідовністю, з якою зв'язуються рецептори експорту з ядра (білки, подібні за структурою з рецепторами імпорту).
Детальніше це питання розглянуто в розділі Ядерні пори
Транспорт білків з апарату Гольджі на зовнішню мембрану Правити
Білки, вбудовані в мембрану ЕРС і потрапили звідти в складі везикул в АГ, можуть переміщатися на зовнішню мембрану клітини. Їх напрямок до мембрани здійснюється завдяки взаємодії везикул з мікротрубочками цитоскелета і завдяки особливим стикувальним білків, які забезпечують злиття везикул з мембраною.
Секреторна функція апарату Гольджі Правити
Ендоцитоз: фагоцитоз і піноцитозу Правити
[1] - Анімація пиноцитоза (на прикладі поглинання холестерину в сотаве ЛПНЩ) (англ.текст)
Екзоцитоз і трансцитозу Правити
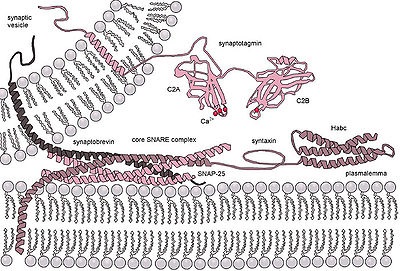
Молекулярна машина екзоцітозного вивільнення нейромедіатора в синапсі. SNARE комплекс формується за рахунок утворення четирёхспіральной зчіпки між сінаптобревіном. сінтаксін і SNAP-25. Синаптотагмін служить кальцієвих сенсором і внутрішнім регулятором освіти білкового комплексу
Екзоцитоз є як у еукаріот, так іу прокаріотів. Екзоцитоз (від грец. Έξω - зовнішній і κύτος - клітина) у еукаріот - клітинний процес, при якому внутрішньоклітинні везикули (мембранні пухирці) зливаються з зовнішньої клітинної мембраною. При екзоцитозу вміст секреторних везикул (екзоцітозних бульбашок) виділяється назовні, а їх мембрана зливається з клітинною мембраною. Практично всі макромолекулярні сполуки (білки, пептидні гормони та ін.) Виділяються з клітин еукаріот цим способом.
У прокаріотів везикулярний механізм екзоцитозу не зустрічається, у них екзоцитозу називають вбудовування білків у клітинну мембрану (або в зовнішню мембрану у грамнегативних бактерій), виділення білків з клітки в зовнішнє середовище або в Периплазма [1].
Екзоцитоз може виконувати різні завдання:
- доставка на клітинну мембрану ліпідів, необхідного для росту клітини;
- доставка на клітинну мембрану мембранних білків. таких як рецептори або білки-транспортери. При цьому частина білка, яка була спрямована всередину секреторною везикули, виявляється виступає на зовнішній поверхні клітини;
- виділення різних речовин з клітини; це можуть бути, наприклад, неперетравлені залишки їжі у фаготрофних протистов, травні ферменти у тварин з порожнинних травленням, білки міжклітинного речовини у тварин і матеріал клітинної стінки у рослин, сигнальні молекули (гормони або нейромедіатори).
У еукаріот розрізняють два типи екзоцитозу:
- Кальцій-незалежно конститутивний екзоцитоз зустрічається практично у всіх клітині. Це необхідний процес для побудови позаклітинного матриксу та доставки білків на зовнішню клітинну мембрану. При цьому секреторні везикули доставляються до поверхні клітини і зливаються з зовнішньою мембраною в міру їх утворення.
- Кальцій-залежний неконстітутівний екзоцитоз зустрічається, наприклад, в хімічних w: синапсах або клітинах, які б виробляли макромолекулярні гормони і служить, наприклад, для виділення нейромедіаторів. При цьому типі екзоцитозу секреторні пухирці накопичуються в клітці, а процес їх вивільнення запускається за певним сигналом, опосередкованого швидким підвищенням концентрації іонів кальцію в цитоплазмі клітини. У пресинаптичних мембранах процес здійснюється спеціальним кальцій-залежним білковим комплексом [w: [SNARE |]].
Внутрішньоклітинне травлення Правити
Механізм внутрішньоклітинного травлення Правити
Роль внутрішньоклітинного травлення для тварин Правити
Аутофагія, її роль Правити
Аутофагія (від грец. Αὐτός - сам і φαγεῖν - «є»), «самопожирання» - це процес, при якому компоненти клітини доставляються всередину її лізосом і піддаються в них деградації.
Зараз розрізняють три типи аутофагії - мікроаутофагію, макроаутофагію і шаперон-залежну Аутофагія.
При мікроаутофагіі, як при утворенні мультивезикулярні тілець, утворюються впячивания мембрани ендосоми або лізосоми, які потім відділяються у вигляді внутрішніх бульбашок, тільки в них потрапляють речовини, синтезовані в самій клітині. Таким шляхом клітина може перетравлювати білки при нестачі енергії або будівельного матеріалу (наприклад, при голодуванні). Але процеси мікроаутофагіі відбуваються і при нормальних умовах і в цілому невибіркову. Іноді в ході мікроаутофагіі перетравлюються і органели; так, у дріжджів описана мікроаутофагія пероксисом і часткова мікроаутофагія ядер, при якій клітина зберігає життєздатність.
При макроаутофагіі ділянку цитоплазми (часто містить будь-які органели) оточується мембранним компартментом, схожим на цистерну ендоплазматичноїмережі. В результаті ця ділянка відокремлюється від решти цитоплазми двома мембранами. Такі двухмембранной органели, що оточують видаляються органели і цитоплазму, називаються аутофагосоми. Аутофагосоми з'єднуються з лізосомами. утворюючи аутофаголізосоми, в яких органели і решта вмісту аутофагосом перетравлюються.
Мабуть, макроаутофагія також невибіркову, хоча часто підкреслюється, що за допомогою неї клітина може позбавлятися від «закінчення їхнього терміну служби» органоїдів (мітохондрій. Рибосом і ін.).
Третій тип аутофагії - шаперон-опосередкована. При цьому способі відбувається спрямований транспорт частково денатурованого білків з цитоплазми крізь мембрану лізосоми в її порожнину, де вони перетравлюються. Цей тип аутофагії, описаний тільки для ссавців, індукується стресом. Вона відбувається за участю цитоплазматичних білків-шаперонов сімейства hsc-70, допоміжних білків і LAMP-2. який служить мембранним рецептором комплексу шаперона і білка, що підлягає транспорту в лизосому.
При аутофагіческом типі клітинної загибелі перетравлюються все органели клітини, залишаючи лише клітинний дебрис. поглинається макрофагами.