Будова і функції білків
1. Чому білки вважаються полімерами?
2. Які функції білків вам відомі?
У клітинах різних живих організмів зустрічається понад 170 різних амінокислот, але нескінченна різноманітність білків створюється за рахунок різного поєднання всього 20 амінокислот. З них може бути утворено 2 432 902 008 176 640 000 комбінацій, т. Е. Різних білків, які будуть володіти абсолютно однаковим складом, але різною будовою. Але і це величезне число не межа - білок може складатися і з більшої кількості амінокислотних залишків, і, крім того, кожна амінокислота може зустрічатися в білку кілька разів.
Молекула амінокислоти складається з двох однакових для всіх амінокислот частин, одна з яких є аминогруппой (-NH2) з основними властивостями, інша - карбоксильною групою (-СООН) з кислотними властивостями. Частина молекули, звана радикалом (R), у різних амінокислот має різну будову (рис. 12).
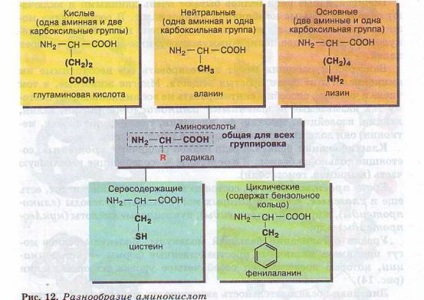
Наявність в одній молекулі амінокислоти і основний, і кислотної груп обумовлює їх амфотерность і високу реактивність. Через ці групи відбуваються з'єднання амінокислот при утворенні білка. В ході реакції полімеризації виділяється молекула води. а звільнені електрони утворюють ковалентний зв'язок, яка отримала назву пептидного - утворюється пептид (грец. peptos - зварений). До вільних карбоксильної і аміногрупи можуть приєднуватися інші амінокислоти, подовжуючи «ланцюг», що називається поліпептидного. На одному кінці такого ланцюга завжди буде група МН2 (цей кінець називається N-кінцем), а на іншому кінці - група СООН (цей кінець отримав назву С-кінця) (рис. 13).
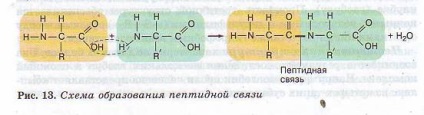
Поліпептидні ланцюги білків бувають дуже довгими і включають найрізноманітніші комбінації амінокислот. До складу білка може входити не одна, а дві поліпептидні ланцюги і більш. Так, в молекулі інсуліну - два ланцюги, а імуноглобуліни складаються з чотирьох ланцюгів.
Бактерії і рослини можуть синтезувати всі необхідні їм амінокислоти з простіших речовин. Багато тварин, в тому числі і людина, здатні синтезувати не всі амінокислоти, тому так звані незамінні амінокислоти (лізин, валін, лейцин, ізолейцин, треонін, фенілаланін, триптофан, тирозин, метіонін) вони повинні отримувати з їжею в готовому вигляді.
Серед білків розрізняють протеїни, що складаються тільки з білків, і протеїди - містять небілкової частина (наприклад, гемоглобін).
Крім простих білків, що складаються тільки з амінокислот, є ще й складні, до складу яких можуть входити вуглеводи (глікопротеїди), жири (ліпопротеїди), нуклеїнові кислоти (нуклеопротеїни) і ін.
Рівні організації білкової молекули.
Молекули білків можуть приймати різні просторові форми - конформації, які представляють собою чотири рівні їх організації (рис. 14).
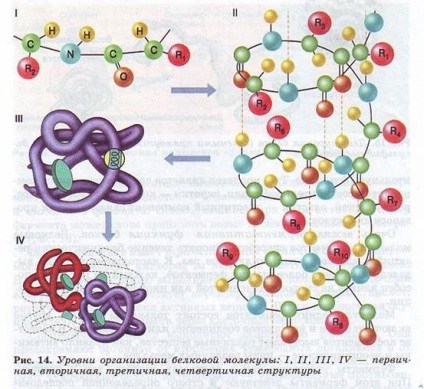
Лінійна послідовність амінокислот у складі поліпептидного ланцюга являє первинну структуру білка. Вона унікальна для будь-якого білка і визначає його форму, властивості і функції.
Вторинна структура білків виникає в результаті утворення водневих зв'язків між групами СООН і -NH2-різному амінокислотних залишків поліпептидного ланцюга. Хоча водневі зв'язку маломіцні, але завдяки їх значній кількості в комплексі вони забезпечують досить міцну структуру.
Третинна структура являє собою химерну, але для кожного білка специфічну конфігурацію, що має вигляд клубка (глобулу). Міцність третинної структури забезпечується іонними, водневими і дисульфідними (- S-S-) зв'язками між залишками цистеїну, а також гідрофобною взаємодією.
Четвертичная структура характерна не для всіх білків.
Вона виникає в результаті з'єднання декількох глобул в складний комплекс. Наприклад, гемоглобін крові людини являє комплекс з чотирьох таких субодиниць.
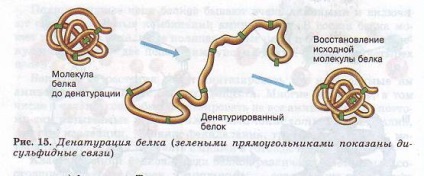
Втрата білковою молекулою своєї природної структури називається денатурацією. Вона може виникати під впливом температури, хімічних речовин, зневоднення, опромінення та інших факторів. Якщо при денатурації не порушена первинна структура, то при відновленні нормальних умов білок здатний відтворювати свою структуру (рис. 15). Звідси випливає, що всі особливості будови макромолекули білка визначаються його первинною структурою.
Білки виконують цілий ряд функцій як в кожній клітині, так і в цілому організмі. Функції білків різноманітні.
Білки є основою всіх біологічних мембран, всіх органоїдів клітини, таким чином вони виконують структурну (будівельну) функцію.- (Рис. 15.). Так, колаген є важливим складовим компонентом сполучної тканини, кератин - компонент пір'я, волосся, рогів, нігтів, еластин - еластичний компонент зв'язок, стінок кровоносних судин.
Дуже важлива ферментативна функція білків.
Білкові молекули ферментів здатні прискорювати перебіг біохімічних реакцій в клітці в сотні мільйонів разів. До теперішнього часу виділено і вивчено понад тисячу ферментів, кожен з яких здатний впливати на швидкість течії тієї чи іншої біохімічної реакції.
Молекули одних ферментів складаються тільки з білків, інші включають білок і небілкових з'єднання, або кофермент, Як коферментів виступають різні речовини, як правило вітаміни і неорганічні - іони різних металів.
Ферменти беруть участь як у процесах синтезу, так і розпаду. При цьому ферменти діють в строго визначеної послідовності, вони специфічні для кожної речовини і прискорюють тільки певні реакції. Зустрічаються ферменти, які каталізують кілька реакцій. Вибірковість дії ферментів на різні хімічні речовини пов'язана з їх будовою. Каталітична активність ферменту визначається не всієї його молекулою, а певною ділянкою молекули ферменту, який називається його активним центром.
Субстрат взаємодіє з ферментом, причому зв'язування субстрату здійснюється саме в активному центрі, Форма і хімічну будову активного центру такі, що з ним можуть зв'язуватися тільки певні молекули в силу їх просторового відповідності, вони підходять один до одного, «як ключ до замка».
На заключному етапі хімічної реакції комплекс «фермент-субстрат» розпадається з утворенням кінцевих продуктів і вільного ферменту. Звільнився при цьому активний центр може знову приймати нові молекули речовини-субстрату (рис. 16).
Важливе значення має транспортна функція білків.
Так, гемоглобін переносить кисень з легень до клітин інших тканин. У м'язах цю функцію виконує білок міоглобін. Сироватковий альбумін крові сприяє переносу ліпідів і жирних кислот, різних біологічно активних речовин. Білки-переносники здійснюють перенесення речовин через клітинні мембрани.
Специфічні білки виконують захисну функцію. Вони оберігають організм від вторгнення чужорідних організмів і від пошкодження. Так, антитіла, що виробляються лімфоцитами, блокують чужорідні білки; інтерферони - універсальні противірусні білки; фібриноген, тромбін та інші оберігають організм від крововтрати, утворюючи тромб.
Багато живих істот для забезпечення захисту виділяють білки, звані токсинами, які в більшості випадків є сильними отрутами. У свою чергу, деякі організми здатні виробляти антитоксинів, які пригнічують дію цих отрут.
Білки можуть виконувати енергетичну функцію, будучи одним з джерел енергії в клітині. При повному розщеплюванні 1 г білка до кінцевих продуктів виділяється 17,6 кДж енергії. Але як джерело енергії білки використовуються вкрай рідко. Амінокислоти, що вивільняються при розщепленні білкових молекул, використовуються для побудови нових білків.
Роль білка в житті клітини величезна. Сучасна біологія показала, що схожість і відмінність організмів визначаються в кінцевому рахунку набором білків. Чим ближче організми один до одного в систематичному положенні, тим більше схожі їх білки.
Білки. Протеїни. Протеїди. Пептид. Пептидний зв'язок. Прості і складні білки. Первинна, вторинна, третинна і четвертинна структури білків. Денатурація.
1. Які речовини називаються білками?
2. Що таке первинна структура білка?
3. Як утворюються вторинна, третинна і четвертинна структури білка?
4. Що таке денатурація білка?
5. За якою ознакою білки діляться на прості і складні?
6. Які функції білків вам відомі?
7. Яку роль виконують білки-гормони?
8. Яку функцію виконують білки-ферменти?
9. Чому білки рідко використовуються в якості джерела енергії?
Білок яйця є типовим протеїном. З'ясуйте, що з ним станеться, якщо на нього подіяти водою, спиртом, ацетоном, кислотою, лугом, рослинним маслом, високою температурою і т. Д.
1. Подрібніть бульба сирої картоплі до стану кашки. Візьміть три пробірки і в кожну покладіть невелику кількість подрібненого картоплі.
Першу пробірку помістіть в морозилку холодильника, другу - на нижню полицю холодильника, а третю - в банку з теплою водою (t = 40 ° С). Через 30 хв дістаньте пробірки і в кожну капніть невелику кількість пероксиду водню. Поспостерігайте, що буде відбуватися в кожній пробірці. Поясніть отримані результати.
2. Візьміть три пробірки і в кожну з них покладіть невелику кількість подрібненого сирої картоплі. В першу пробірку з картоплею капніть кілька крапель води, в другу - кілька крапель кислоти (столовий оцет), а в третю - луги.
Поспостерігайте, що буде відбуватися в кожній пробірці. Поясніть отримані результати. Зробіть висновки.
Ферменти значно перевершують інші каталізатори по специфічності, каталітичної активності та здатні діяти в м'яких умовах (низькі температури, нормальний тиск і т.д.). Вони здатні протягом мілісекунд забезпечити протікання складних багатостадійний реакцій, для проведення яких хіміку в сучасній лабораторії потрібні були б дні, тижні або навіть місяці. Наприклад, одна молекула ферменту каталази розщеплює в 1 хв більше 5 млн молекул пероксиду водню (Н2О2), який утворюється в організмі при окисленні різних з'єднань.
Так як молекули білків, побудовані з амінокислот, надзвичайно великі і складні, то для їх зображення використовують спеціальну загальноприйняту символіку. Кожна амінокислота позначається трьома латинськими буквами.
Багато живі організми здатні виробляти одні амінокислоти з інших і тому їм не дуже важливо, які амінокислоти містяться в білках їжі. Але деякі тварини, в тому числі осіб, повинні отримувати переважна кількість амінокислот з їжею, так як ряд амінокислот, званих незамінними, в їх організмі не виробляється, але вони необхідні для життєдіяльності.
Каменський А. А. Кріксунов Е. В. Пасічник В. В. Біологія 10 клас
Відправлено читачами з інтернет-сайту
Онлайн бібліотека з учнями і книгами, плани-конспекти уроків з Біології 10 класу, книги та підручники згідно календарного плану планування Біології 10 класу
Якщо у вас є виправлення або пропозиції до даного уроку, напишіть нам.
Якщо ви хочете побачити інші коригування та побажання до уроків, дивіться тут - Освітній форум.