К.х.н. О.В. Мосін
Вода - речовина звичне і незвичайне. Майже 3/4 поверхні нашої планети зайнято океанами і морями. Твердою водою - снігом і льодом - покрито 20% суші. Від води залежить клімат планети. Геофізики стверджують, що Земля давно б охолола і перетворилася в неживий шматок каменю, якби не вода. У неї дуже велика теплоємність. Нагріваючись, вона поглинає тепло; остигаючи, віддає його. Земна вода і поглинає, і повертає дуже багато тепла і тим самим "вирівнює" клімат. А від космічного холоду охороняє Землю ті молекули води, які розсіяні в атмосфері - в хмарах і у вигляді пари.
Вода - найзагадковіше речовина в природі після ДНК, що володіє унікальними властивостями, які не тільки ще повністю не пояснені, але далеко не всі відомі. Чим довше її вивчають, тим більше знаходять нових аномалій і загадок в ній. Більшість з цих аномалій, що забезпечують можливість життя на Землі, пояснюються наявністю між молекулами води водневих зв'язків, які багато сильніше вандерваальсовскіх сил тяжіння між молекулами інших речовин, але на порядок величини слабкіше іонних і ковалентних зв'язків між атомами в молекулах. Такі ж водневі зв'язку також присутні і в молекулі ДНК.
Молекула води (H216O) складається з двох атомів водню (H) і одного атома кисню (16O). Виявляється, що чи не все різноманіття властивостей води і незвичність їх прояву визначається, в кінцевому рахунку, фізичної природою цих атомів, способом їх об'єднання в молекулу і угрупованням утворилися молекул.
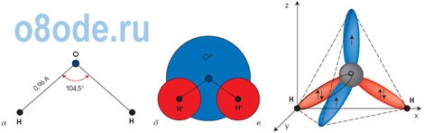
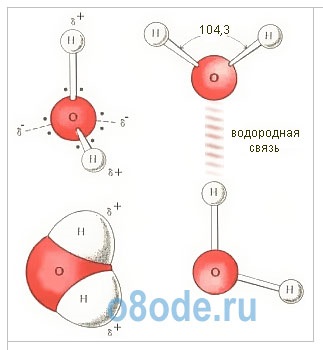
Мал. Будова молекули води. Геометрична схема (а), плоска модель (б) і просторова електронна структура (в) мономера H2O. Два з чотирьох електронів зовнішньої оболонки атома кисню беруть участь в створенні ковалентних зв'язків з атомами водню, а два інших утворюють сильно витягнуті електронні орбіти, площина яких перпендикулярна площині Н-О-Н.
Молекула води H2O побудована у вигляді трикутника: кут між двома зв'язками кисень - водень 104 градуси. Але оскільки обидва водневих атома розташовані по одну сторону від кисню, електричні заряди в ній розосереджуються. Молекула води полярна, що є причиною особливого взаємодії між різними її молекулами. Атоми водню в молекулі H2O, маючи частковий позитивний заряд, взаємодіють з електронами атомів кисню сусідніх молекул. Така хімічна зв'язок називається водневої. Вона об'єднує молекули H2O в своєрідні асоціати просторової будови; площину, в якій розташовані водневі зв'язку, перпендикулярні площині атомів тієї ж молекули H2O. Взаємодією між молекулами води і пояснюються в першу чергу незакономерно високі температури її плавлення і кипіння. Потрібно підвести додаткову енергію, щоб розхитати, а потім зруйнувати водневі зв'язку. І енергія ця дуже значна. Ось чому така велика теплоємність води.
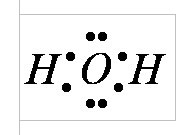
Відповідно до електронним будовою атомів водню і кисню молекула води в своєму розпорядженні чотири електронними парами. Дві з них беруть участь в утворенні ковалентних зв'язків з двома атомами водню, тобто є зв'язують. Дві інші електронні пари є вільними - не зв'язуватися. Вони утворюють електронне хмара. Хмара неоднорідне - в ньому можна розрізнити окремі згущення і розрідження.
У молекулі води є чотири полюс зарядів: два - позитивні і два - негативні. Позитивні заряди зосереджені у атомів водню, так як кисень електронегативний водню. Два негативних полюси припадають на дві які не пов'язують електронні пари кисню.
У кисневого ядра створюється надлишок електронної щільності. Внутрішня електронна пара кисню рівномірно обрамляє ядро: схематично вона представлена колом з центром -ядро O2-. Чотири зовнішніх електрона групуються в дві електронні пари, які тяжіють до ядра, але частково не компенсувати. Схематично сумарні електронні орбіталі цих пар показані у вигляді еліпсів, витягнутих від загального центру - ядра O2-. Кожен з решти двох електронів кисню утворює пару з одним електроном водню. Ці пари також тяжіють до кисневого ядра. Тому водневі ядра - протони - виявляються кілька оголеними, і тут спостерігається нестача електронної густини.
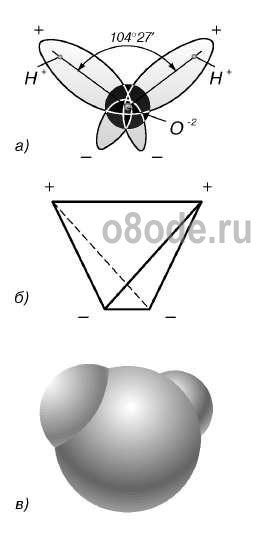
Мал. Будова молекули води: а - кут між зв'язками O-H; б - розташування полюсів заряду; в - зовнішній вигляд електронного хмари молекули води.
Майже куляста молекула води має помітно виражену полярність, так як електричні заряди в ній розташовані асиметрично. Кожна молекула води є мініатюрним диполем з високим дипольним моментом - 1,87 Дебая. Дебай - позасистемна одиниця електричного дипольного 3,33564 · 1030 Кл · м. Під впливом диполів води в 80 разів слабшають міжатомних або міжмолекулярні сили на поверхні зануреної в неї речовини. Інакше кажучи, вода має високу діелектричну проникність, найвищу з усіх відомих нам сполук.
Багато в чому завдяки цьому, вода проявляє себе як універсальний розчинник. Її растворяющему дії в тій чи іншій мірі підвладні і тверді тіла, і рідини, і гази.
Питома теплоємність води найбільша серед усіх речовин. Крім того, вона в 2 рази вище, ніж у льоду, в той час як у більшості простих речовин (наприклад, металів) в процесі плавлення теплоємність практично не змінюється, а у речовин з багатоатомних молекул вона, як правило, зменшується при плавленні.
Подібне уявлення про будову молекули дозволяє пояснити багато властивостей води, зокрема структуру льоду. У кристалічній решітці льоду кожна з молекул оточена чотирма іншими. У площинному зображенні це можна уявити так:
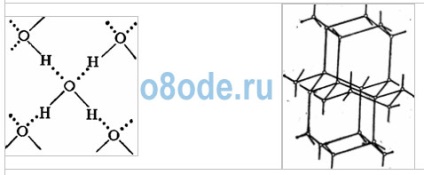
Зв'язок між молекулами здійснюється за допомогою атома водню. Позитивно заряджений атом водню однієї молекули води притягається до негативно зарядженого атому кисню іншої молекули води. Такий зв'язок отримала назву водневої (її позначають точками). По міцності воднева зв'язок приблизно в 15 - 20 разів слабкіше ковалентної зв'язку. Тому воднева зв'язок легко розривається, що спостерігається, наприклад, при випаровуванні води.
Структура рідкої води нагадує структуру льоду. У рідкої воді молекули також пов'язані один з одним за допомогою водневих зв'язків, проте структура води менш "жорстка", ніж у льоду. Внаслідок теплового руху молекул у воді одні водневі зв'язки розриваються, інші утворюються.
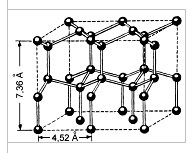
Мал. Кристалічна решітка льоду. Молекули води H2O (чорні кульки) в її вузлах розташовані так, що кожна має чотирьох "сусідок".
Полярність молекул води, наявність в них частково компенсуються електричних зарядів породжує схильність до групування молекул в укрупнені «співтовариства» - асоціати. Виявляється, повністю відповідає формулі Н2О лише вода, яка перебуває в пароподібному стані. Це показали результати визначення молекулярної маси водяної пари. В температурному інтервалі від 0 до 100 ° С концентрація окремих (мономерних молекул) рідкої води не перевищує 1%. Всі інші молекули води об'єднані в асоціати різного ступеня складності, і їх склад описується загальною формулою (H2O) x.
Безпосередньою причиною утворення асоціатів є водневі зв'язки між молекулами води. Вони виникають між ядрами водню одних молекул та електронними «згущеннями» у ядер кисню інших молекул води. Правда, ці зв'язки в десятки разів слабкіше, ніж «стандартні» внутрішньо-молекулярні хімічні зв'язки, і достатньо звичайних рухів молекул, щоб зруйнувати їх. Але під впливом теплових коливань так само легко виникають і нові зв'язки цього типу. Виникнення і розпад асоціатів можна виразити схемою:
x · H2O- (H2O) x
Оскільки електронні орбіталі в кожній молекулі води утворюють тетраедричних структуру, водневі зв'язки можуть упорядкувати розташування молекул води у вигляді тетраедричних координованих асоціатів.
Більшість дослідників пояснюють аномально високу теплоємність рідкої води тим, що при плавленні льоду його кристалічна структура руйнується не відразу. У рідкої воді зберігаються водневі зв'язки між молекулами. У ній залишаються як би уламки льоду - асоціати з великого чи меншого числа молекул води. Однак на відміну від льоду кожен ассоциат існує недовго. Постійно відбувається руйнування одних і утворення інших ассоциатов. При кожному значенні температури в воді встановлюється своє динамічна рівновага в цьому процесі. А при нагріванні води частина теплоти витрачається на розрив водневих зв'язків в асоціати. При цьому на розрив кожної зв'язку витрачається 0,26-0,5 еВ. Цим і пояснюється аномально висока теплоємність води в порівнянні з розплавами інших речовин, що не утворюють водневих зв'язків. При нагріванні таких розплавів енергія витрачається тільки на повідомлення теплових рухів їх атомам або молекулам. Водневі зв'язки між молекулами води повністю розриваються тільки при переході води в пару. На правильність такої точки зору вказує і та обставина, що питома теплоємність водяної пари при 100 ° С практично збігається з питомою теплоємністю льоду при 0 ° С.
Малюнок нижче:
Елементарним структурним елементом асоціата є кластер: Рис. Окремий гіпотетичний кластер води.Отдельние кластери утворюють асоціати молекул води (H2O) x: Рис. Кластери з молекул води утворюють асоціати.

Існує й інша точка зору на природу аномально високій теплоємності води. Професор Г. Н. Зацепіна помітила, що молярна теплоємність води, яка становить 18 кал / (мольград), точно дорівнює теоретичної молярної теплоємності твердого тіла з трехатомного кристалами. А відповідно до закону Дюлонга і Пті атомні теплоємності всіх хімічно простих (одноатомних) кристалічних тіл при досить високій температурі однакові і рівні 6 калДмоль o град). А для трьохатомних, в граммоле яких міститься 3 Nа вузлів кристалічної решітки, - в 3 рази більше. (Тут Nа - число Авогадро).
Звідси випливає, що вода є як би кристалічним тілом, що складається з трьохатомних молекул Н20. Це відповідає поширеному уявленню про воду як суміші кристалоподібні ассоциатов з невеликою домішкою вільних молекул H2O води між ними, число яких зростає з підвищенням температури. З цієї точки зору викликає здивування невисока теплоємність рідкої води, а низька твердого льоду. Зменшення питомої теплоємності води при замерзанні пояснюється відсутністю поперечних теплових коливань атомів в жорсткій кристалічній решітці льоду, де у кожного протона, що обумовлює водневу зв'язок, залишається тільки одна ступінь свободи для теплових коливань замість трьох.
Але за рахунок чого і як можуть відбуватися настільки великі зміни теплоємності води без відповідних змін тиску? Щоб відповісти на це питання, познайомимося з гіпотезою кандидата геолого-мінералогічних наук Ю. А. Коляснікова про структуру води.
Він вказує, що ще першовідкривачі водневих зв'язків Дж. Бернал і Р. Фаулер в 1932 р порівнювали структуру рідкої води з кристалічною структурою кварцу, а ті асоціати, про які говорилося вище, - це в основному тетрамери 4Н20, в яких чотири молекули води з'єднані в компактний тетраедр з дванадцятьма внутрішніми водневими зв'язками. В результаті утворюється чотиригранна піраміда - тетраедр.
При цьому, водневі зв'язки в цих тетрамера можуть утворювати як право- так і левовінтовую послідовності, подібно до того, як кристали широко розповсюдженого кварцу (Si02), теж мають тетраедричних структуру, бувають право- і ліво-обертальної кристалічної форм. Оскільки кожен такий тетрамер води має ще й чотири незадіяні зовнішні водневі зв'язку (як у однієї молекули води), то тетрамери можуть з'єднуватися цими зовнішніми зв'язками в свого роду полімерні ланцюжки, на зразок молекули ДНК. А оскільки зовнішніх зв'язків всього чотири, а внутрішніх - в 3 рази більше, то це дозволяє важким і міцним тетрамера в рідкій воді згинати, повертати і навіть надломлювати ці ослаблені тепловими коливаннями зовнішні водневі зв'язку. Це і обумовлює плинність води.
Таку структуру вода, на думку Коляснікова, має тільки в рідкому стані і, можливо, частково в пароподібному. А ось в льоду, кристалічна структура, якого добре вивчена, тетрагідролі з'єднані між собою негнучкими равнопрочность прямими водневими зв'язками в ажурний каркас з великими порожнечами в ньому, що робить щільність льоду менше щільності води.

Коли ж лід тане, частина водневих зв'язків в ньому слабшає і згинається, що веде до перебудови структури в вищеописані тетрамери і робить рідку воду більш щільною, ніж лід. При 4 ° С настає стан, коли все водневі зв'язку між тетрамерами максимально зігнуті, ніж і обумовлюється максимум щільності води при цій температурі. Далі зв'язків гнутися нікуди.
При температурі вище 4 ° С починається розривання окремих зв'язків між тетрамерами, і при 36-37 ° С виявляється розірвана половина зовнішніх водневих зв'язків. Це і визначає мінімум на кривій залежності питомої теплоємності води від температури. При температурі ж 70 ° С розірвані вже майже все межтетрамерние зв'язку, і поряд з вільними тетрамерами в воді залишаються тільки короткі уривки "полімерних" ланцюжків з них. Нарешті при кипінні води відбувається остаточний розрив тепер уже одиночних тетрамеров на окремі молекули Н20. І та обставина, що питома теплота випаровування води рівно в 3 рази більше суми питомих теплот плавлення льоду і подальшого нагрівання води до 100 ° С, є підтвердженням припущення Коляснікова про те. що число внутрішніх зв'язків в тетрамере в 3 рази більше числа зовнішніх.