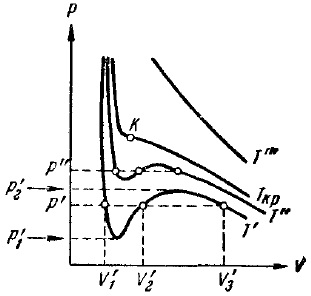
Рис.9. Ізотерми Ван-дер-Ваальса
На рис. 9 зображені ізотерми Ван-дер-Ваальса для кількох значень температури. При температурі Т 'ідавленіях в межах р'1 до р'2 коефіцієнти в (32) є такими, що всі три рішення рівняння виявляються речовими; при інших тисках речовим буде тільки одне рішення. Різниця між трьома речовими рішеннями рівняння з підвищенням температури зменшується (пор. Ізотерми Т 'і Т "; Т"> Т'). Починаючи з певної, своєю для кожного речовини температури Ткр при будь-якому тиску речовим залишається тільки одне рішення рівняння (32). Температура Ткр називається критичною. Якщо підвищувати температуру, то точки, відповідні рішенням рівняння V'1. V'2 і V'3 все більше зближуються, зливаючись при критичній температурі в одну, позначену на рис. 9 буквою К. Точка К називається критичною. Для відповідної ізотерми До служить точкою перегину. Їй відповідають три співпадаючих речових рішення рівняння (32). Дотична до критичної изотерме в точці К є межею, до якого прагнуть січні р ', р "і т. Д. При наближенні температури до критичної. Отже, ця дотична, як і всі січні, паралельна осі V, що похідна в точці К дорівнює нулю. Крім того, в якій точці перегину повинна бути дорівнює нулю друга похідна.
Для того щоб отримати ізотерму досвідченим шляхом, потрібно взяти речовина в газоподібному стані, помістити його в посудину з переміщається поршнем (рис. 10) і почати повільно стискати, роблячи одночасні відліки тиску і обсягу, а також стежачи за тим, щоб температура речовини лишалася незмінною . Результати подібних дослідів для температури нижче критичної дані на рис. 11. Спочатку зі зменшенням обсягу тиск газу зростає, причому хід ізотерми досить добре описується рівнянням Ван-дер-Ваальса. Однак, починаючи з деякого значення обсягу Vг. експериментальна ізотерма перестає слідувати рівняння (31). Починаючи з цього значення об'єму, тиск в посудині перестає змінюватися, саме ж речовина при цьому перестає бути однорідним: частина газу конденсується в рідину. Відбувається, як кажуть, розшарування речовини на дві фази: рідку і газоподібну. У міру подальшого зменшення обсягу все більша частина речовини переходить в рідку фазу, причому перехід здійснюється при постійному тиску, позначеному на малюнку рн.п.
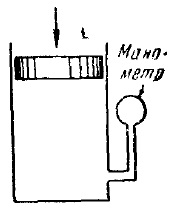
Рис.10. Схема установки для отримання експериментальних ізотерм
Після того як процес конденсації речовини в рідину закінчується (це відбувається при досягненні обсягу Vж), подальше зменшення обсягу починає супроводжуватися швидким зростанням тиску. При цьому хід ізотерми знову приблизно слід рівняння (31). Речовина в станах, відповідних цій ділянці ізотерми, знову буде однорідним, але є не газ, а рідина.
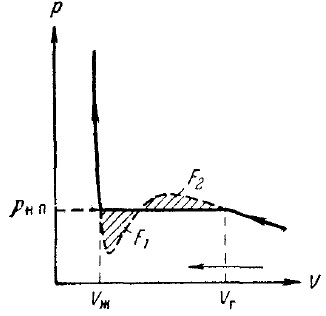
Рис.11. Ізотерма реального газу
Таким чином, рівняння Ван-дер-Ваальса описує не тільки газоподібний стан речовини, але охоплює також процес переходу в рідкий стан і процес стиснення рідини.
Зіставлення експериментальної ізотерми з ізотермою Ван-дер-Ваальса дає, що ці ізотерми досить добре збігаються на ділянках, що відповідають одне-фазним станам речовини, але поводяться зовсім по-різному в області розшарування на дві фази. Замість S-образного завитка на изотерме Ван-дер-Ваальса експериментальна ізотерма має в цій області прямолінійний горизонтальний ділянку, який розташовується так, що охоплюються завитком площі F1 і F2 (рис. 10) однакові.
У станах, відповідних горизонтальному ділянці ізотерми, спостерігається рівновага між рідкою і газоподібною фазами речовини. Газ (або пар), що знаходиться в рівновазі зі своєю рідиною, називається насиченою парою. Тиск РНП, при якому може існувати рівновага при даній температурі, називається тиском (або пружністю) насиченої пари.
Ставлення мас рідини і насиченої пари в двофазному стані дорівнює відношенню відрізків, на які ділить горизонтальну ділянку ізотерми точка, яка зображує стан.
На рис. 12 наведені експериментальні ізотерми для кількох значень температури. Як видно з малюнках, з підвищенням температури горизонтальну ділянку ізотерми скорочується, стягуючи в точку при критичній температурі Ткр. Відповідно до цього зменшується різниця в питомих обсягах, а отже, і щільності рідини і насиченої пари. При критичній температурі ця різниця повністю зникає. Одночасно зникає яке розрізнення між рідиною і парою.
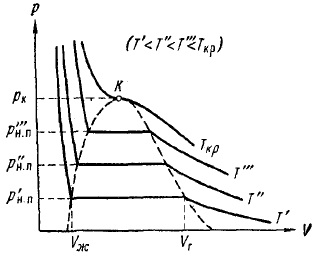
Ріс.12.Експеріментальние ізотерми для одного і того ж газу при різних температурах
З рис. 12 випливає, що тиск насиченої пари зростає з температурою, досягаючи в критичній точці значення ркр. Залежність рн. п від температури дана на рис. 13. Крива закінчується в критичній точці, так як при температурах вище критичної поняття насиченого пара втрачає сенс. Починається крива в так званій потрійний точці Тр. Крива на рис. 13 являє собою геометричне місце точок (значень тисків і температур), в яких знаходяться в рівновазі рідка і газоподібна фази. Потрійна точка - це точка рівноваги трьох фаз: твердої, рідкої і газоподібної.
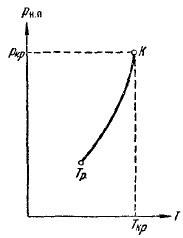
Мал. 13. Залежність тиску насиченої пари від температури
Якщо провести лінію через крайні точки горизонтальних ділянок ізотерм (рис. 12), виходить колоколообразная крива, що обмежує область двофазних станів речовини. При температурах вище критичної речовина при будь-якому тиску виявляється однорідним. При таких температурах ніяким стисненням не може бути здійснено зрідження речовини.
Поняття критичному температури вперше було введено Д. І. Менделєєвим в 1860 р Менделєєв назвав її температурою абсолютного кипіння рідини і рас-подивлявся як ту температуру, при якій зникають сили зчеплення між молекулами і рідина перетворюється на пару, незалежно від тиску і займаного нею обсягу .
Колоколообразная крива і ділянку критичної ізотерми, що лежить зліва від точки К, ділять діаграму (р, V) на три області (рис. 14). Похилій штрихуванням позначена область однорідних рідких станів речовини. Під колоколообразной кривої розташовується, як ми знаємо, область двофазних станів і, нарешті, область, що лежить праворуч від колоколообразной кривої і верхньої гілки критичної ізотерми, являє собою область однорідних газоподібних стані речовини. В останній можна особливо виділити частину, що лежить під правою гілкою критичної ізотерми, назвавши її областю пара. Будь-яке стан в цій галузі відрізняється від інших газоподібних станів в тому відношенні, що при ізотермічному стисканні речовина, спочатку знаходилося в такому стані, зазнає процес зрідження. Речовина, що знаходиться в одному з станів при температурі вище критичної, не може бути зріджений ніяким стисненням. Підрозділ газоподібних станів на газ і пар не є загальноприйнятим.
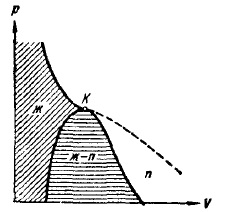
Мал. 14. Три області станів реального газу
Вибравши процес переходу так, щоб він не перетинав двухфазную область, можна здійснити перехід з рідкого стану в газоподібний (або назад) без розшаровування речовини на дві фази. В цьому випадку в процесі переходу речовина буде весь час залишатися однорідним.
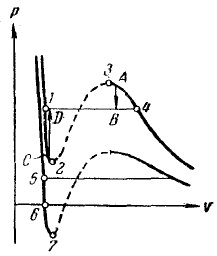
Мал. 15. Метастабільні стану
З зіставлення ізотерми Ван-дер-Ваальса з експериментальної изотермой ми з'ясували, що замість S-образного завитка 1-2 -3 -4 (рис. 15) експери-ва ізотерма має прямолінійний ділянку 1-4, відповідний двофазним станів речовини. Це пояснюється нестійкістю однорідних станів, що відповідають завитку 1 -2 -3-4. Нестійкість станів на ділянці 2 -3 стає очевидною, якщо врахувати, що на цій ділянці похідна позитивна. Отже, речовина, здатне пройти послідовність станів 2 -3, мало б зовсім протиприродними властивостями: збільшення обсягу газу супроводжувалося б не зменшенням, а зростанням тиску.
На ділянках 1-2 і 3 -4 негативно, так що, здавалося б, ці ділянки могли б реалізуватися. Дійсно, за певних умов стану, відповідні цим ділянкам, можуть здійснюватися. Правда, вони не цілком стійкі: досить, наприклад, в стані А попадання в пар порошинки, щоб все речовина розпалася на дві фази і перейшло в стан В (див. Вказаний стрілкою перехід А -> В на рис. 15). Подібні не цілком стійкі стани називаються метастабільними. Речовина в станах 1-2 називається перегрітою рідиною, речовина в станах 3 -4 називається пересиченим паром.