швидкість многостадийного процесу, що протікає в Поліферментні системі. залежить від концентрації проміжних продуктів, а також від конц. відповідного ферменту і кофактора. Швидкість кожної стадії визначається стаціонарної конц-їй даного проміжного продукту, а також концентрацією відповідного ферменту. Стаціонарна конц. всіх проміжних продуктів, а також кофакторов визначається співвідношенням швидкостей їх освіти і споживання і залежить не тільки від активності якийсь ферментативної системи, але і від швидкостей інших ферментативних р-ций, в яких брало ці сполуки використовуються.
На активність ферменту в організму, а сл-но на швидкість ферментативної р-ції впливає ряд факторів: спорідненість до субстрату, константа Міхаелеса. температура, рН середовища, конц. субстрату і разл. кофакторов. необхідних для дії ферментів, наявність активаторів і інгібіторів.
Особливу роль в регулюванні активності ферментів грають коферменти.
У разі відсутності в організмі достатньої кількості коферментів і кофакторів активність ферментів знижується.
Активність ферменту залежить від конц. субстрату. бере участь в ферментативної р-ції. При стаціонарному стані р-ції субстрат надходить з такою ж швидкістю, з якою використовується в р-ції. Підвищення конц-ції субстрату викликає прискорення р-ції до нового стаціонарного стану, де нова швидкість р-ції відповідає новій конц-ції субстрату.
Відомі поліферментні системи. в яких швидкість ферментативних р-ций регулюється концентрацією кінцевого продукту в ланцюзі послідовних перетворень. В основі цього виду регуляції лежить інгібування (або активація) ферментів 1-шої стадії біосинтезу кінцевими продуктами р-ції зване пригніченням (або активацією) за типом зворотного зв'язку. Інгібітори і активатори, що діють за принципом зворотного зв'язку, називаються ефекторами.
20 класифікація ферментативних реакцій по порядку. Хім р-ції, происх в біо системах, діляться по молекулярної і за загальним порядком. Мовляв-сть визна-ся числом частинок, які беруть участь в хімічних перетвореннях. Реакції в елементарних актах, яких беруть участь 1, 2 або 3 частки, називають моно-, бі- і тримолекулярного р-ціями. Імовірність зіткнення більше 3-х частинок мала і р-ції протікають в декілька елементарних стадій. Для біо систем характерні моно- і БІМОЛ-ні р-ції. Важливою хар-кой реакцій явл швидкість. Швидкість хімічної процесу - це зростання або зменшення С речовини в часі. Число зіткнень при заданих зовнішніх умовах є ф-цією концентрації реагуючих в-в. Зовнішні умови - температура, тиск, середа. В результаті р-ції частина вихідних молекул витрачається на освіту продуктів р-ції і С вих в-в убуває, при цьому швидкість р-ції падає. Це є причиною того, що моно- і бімолекулярні р-ції йдуть з безперервно спадної швидкістю.
Якщо швидкість р-ції не залежить від С реагентів, то її називають реакцією нульового порядку. Нехай в-во А перетворюється в в-во В зі швидкістю, незалежною від С речовини А. Прикладом можуть бути ферментативні р-ції, що йдуть в умовах надлишку субстрату. Кінетичне рівняння цього процесу має вигляд:
Рішенням цього рівняння є лінійні функції по часу:
b = k0 t + C2. де С - постійна інтегрування
-До t, тому що концентрація зменшується
Ko t, тому що концентрація зростає
Щоб ці рівняння могли бути застосовні на практиці необхідно знайти С при граничних умовах t = 0, a = a0, b = 0.
Реакція першого порядку - це процес, швидкість якого залежить від однієї з концентрацій (від С одного з речовин). Нехай речовина А перетворюється в речовину В зі швидкістю К1.
Рішенням цього ур-ня явл. висловлю:
при почав ум t = 0, a = a0, b = 0, С1 = a0. З в-ва В получ із закону збереження речовини а + b = a0, b = a0-a. Графіческіскі р-ція слід чином:
Р-ція 2го порядку - це процес, швидкість якого залежить від концентрації реагують по-в. Нехай в-ва А і В дають в-во С зі швидкістю К2. Через х позначимо кількість кожн в-ва, витратять на час t. Для кожн з цих в-в х буде один і той же (тому що в-ва взаємодій в соотнош 1: 1) .Кінах ур їм вид: dx \ dt = k2 (a0 - x) (b0 - x) При хат 1го з реагентів р-ція 2го п-ка буде протік за схемою р-ції 1го порядку, т.к. З, напр, в-ва В буде зм-ся.
Особливістю кінетики біологічних процесів є наявність в системі агентів, здатних впливати на швидкість р-ций. До них відносяться ферменти, що каталізують биохим. перетворення. Ферментативна кінетика вивчає закономірності впливу хімічної природи реагуючих речовин і ум. їх взаємодії на швидкість р-ций. На швидкість хім. Р. впливають такі чинники:
-t 0. v швидкість р-ций збільшується зі збільшенням температури до певної межі.
-т.к.ферменти містять Ко-ферменти і метали, то швидкість р.завісіт від концентрації Ко-ферментів і металів.
-присутності в розчині разл. активизаторов і інгібіторів ферментів.
Швидкість р-ций підкоряється закону, згідно з яким реакція йде швидше, чим більше конц. в-в. Нехай ми маємо р-цію А + В С + D
v1 пропорційна добутку концентрацій А і В. v1 концентрація С і D.к1 константа швидкості. це нормована швидкість, тобто вона дорівнює швидкості р-ції при концентрації реагуючих речовин = 1.
Якщо має місце хімічне рівновагу. тобто v1 = v1 то можна записати:
keq константа рівноваги -вона дорівнює добутку концентрації ісх.в-в при стані рівноваги.
На початку 20 в.било встановлено, що якщо концентрацію F підтримувати. t- const, а початкову концентрацію субстрату змінювати в широких межах. то зміна початкової швидкості р-ції виражається прямий з насиченням:
Ця крива показує. що залежність спочатку близька до лінійної (при малих концентраціях субстрату), а потім досягає максимального значення. р-ції першого порядку при малих концентраціях субстрату переходять в р-ції нульового порядку (т.е.прі яких швидкість р-ції не залежить від конц. реагують-х в-в), швидкість р-ції залишається пропорційною концентрації ферменту. Мат. модель F-ого каталізу була розроблена Міхаелесом і Ментеном в 1913р. вони запропонували двухстадийную послідовність процесів:
E + S ES E + P. де Р-продукт, S-субстрат, Е фермент.
на першій оборотної стадії утворюється фермент-субстратної комплекс, який потім необоротно розпадається на кінцевий продукт і звільняє молекулу F для участі в наступному циклі. Кінетичне зміна концентрації реагуючих речовин мають вигляд: ds \ dt = -k2 es + k -1 (es)
dp \ dt = k1 (es) = - ds \ dt
щоб вирішити цю систему рівнянь. накладемо додаткову умову закритості на сістему.Общее кількість s. p в реакції залишається сопst. Заг кількість молекул F також постійно.
використовуючи ці дані запишемо с-му рівнянь так:
накладемо граничні умови: t = 0, t (es)
це означає, що кінетична крива компл. (es) буде містити максимум. Похідна в області макс. des \ dt = 0 - умова стаціонарності процесу E + S Es E + P
рішення рівняння при des \ dt = 0 дає нам:
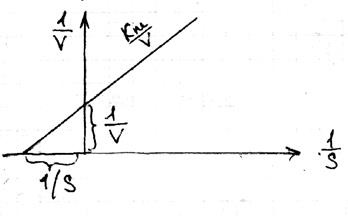
23 рівняння Лайнувера-Берка
За розмірності і фіз.смислу Кm є концентрацію субстрату. при якій половина молекула субстрату, при якому половина молекул ферменту перебуває в стані комплексу. Стационарность ферментативного процесу має місце там, де конкуренція субстрату більше конкуренції ферменту, тобто відбувається безперервний приплив субстрату і відтік продуктів. Для швидкості р-ції
При дуже великій концентрації S, Vстреміться Vmax S \ (k m + S)
Лайнувер і Берк запропонували перейти до лінійної формі. де показують зворотну залежність: 1 \ v = 1 \ vmax (km \ S +1) - рівняння Лайнувер-Берка.
Це у-ня найбільш зручно для перевірки:
Особливістю кінетики біологічних процесів є наявність в системі агентів, здатних впливати на швидкість р-ций. До них відносяться ферменти, що каталізують биохим. перетворення. Ферментативна кінетика вивчає закономірності впливу хімічної природи реагуючих речовин і ум. їх взаємодії на швидкість р-ций. На швидкість хім. Р. впливають такі чинники:
-t 0. v швидкість р-ций збільшується зі збільшенням температури до певної межі.
-т.к.ферменти містять Ко-ферменти і метали, то швидкість р.завісіт від концентрації Ко-ферментів і металів.
-присутності в розчині разл. активизаторов і інгібіторів ферментів.
Швидкість р-ций підкоряється закону, згідно з яким реакція йде швидше, чим більше конц. в-в. Нехай ми маємо р-цію А + В С + D
v1 пропорційна добутку концентрацій А і В. v1 концентрація С і D.к1 константа швидкості. це нормована швидкість, тобто вона дорівнює швидкості р-ції при концентрації реагуючих речовин = 1.
Якщо має місце хімічне рівновагу. тобто v1 = v1 то можна записати:
keq константа рівноваги -вона дорівнює добутку концентрації ісх.в-в при стані рівноваги.
25 стаціонарний стан і класифікація поліферментних систем.
Весь цикл обміну являє собою відкриту систему, в кіт. Весь час надходять в-ва з зовнішнього середовища. Вони зазнають перетворення в організмі і видаляються у вигляді кінцевих продуктів. Регуляція біохімічних процесів в клітині здійснюється за допомогою прямого і зворотного зв'язку. Призначення регуляції полягає в тому, щоб підтримувати концентрації азлічних в-в в клітці на рівні. Кіт. Визначається потребами клітини. Більшість біохімічних реакцій каталізується ферментами, тому механізм регуляції полягає в зміні активності і концентрації ферменту. Поліферментні називається система, взаємопов'язаних ферментів, які каталізують різні стадії метаболічних процесів. Якщо в Поліферментні з-ме концентрації всіх компонентів. а саме ферменту, субстрату і продуктів р-ції, з плином часу залишаються const. то з-ма нах-ся в стаціонарному стані. Відмінність стаціонарної стану від рівноважного, що в стац стані ч \ з с-му проходить постійний стаціонарний потік в-ва і такий стан х-ся const потоком енергії. За своїм складом поліферментні системи можуть бути гомо гетерогенними. Найбільш важливими процесом в поліферментних з-мах можна класифікувати на наступні типи:
Окремо можемо виділити саморегулююча с-ма (с-ми зі зворотним зв'язком)
26свободно радикальні процеси в біологічних системах
в біологічних процесах всі види пластичного синтезу ІЕ енергообміну здійснюється дискретним шляхом, в якому велику роль відіграє одноелектронні передача енергії і утворення парамагнітних частинок з одиночними або неспареними ел-ми (вільні радикали). Вільні радикали мають високу активність. Між числом неспарених ел-нів і поняттям вільна валентність атома є пряме тотожність. По-ва з неспареними е-ми розділені на 2 гр:
-в-ва, у яких неспарені електрони пов'язані або з усією мовляв екулой, або з її здебільшого. Ці неспарені е-ни переміщаються по сильно делокалізованних молекулярним орбиталям і зумовлюють високу активність зовнішніх груп атомів.
-в-ва, у яких неспарені ел-ни зв'язуються з молекулою з одним атомом. Вони не переміщаються по молекулярним орбиталям, які охоплювали всі атоми. Такі неспарені Ел-ни зв. з атомами перехідною групи (Fe, Co, Ni) / ці неспарені електрони являють собою інтерес для дослідження напівпровідникових механізмів.
Саме цим визначається
-монорадікали з одним неспареним Ел-ном (ОН -)
-бірадікали з 2-ма неспареними Ел-ми.