Визначення Ф.Енгельса "Життя є спосіб існування білкових тіл" до сих пір, після майже півтора століття, не втратило своєї правильності та актуальності.
В основі структури будь-якого організму і всіх процесів, в ньому життєвих реакцій лежать білки. Будь-які порушення в цих білках призводять до зміни самопочуття і нашого здоров'я. Необхідність вивчення будови, властивостей і видів білків криється в різноманітті їх функцій.
Білки формують речовина сполучної тканини - колаген. еластин. кератин. протеоглікани.
Безпосередньо беруть участь в побудові мембран і цитоскелету (інтегральні, полуінтегральние і поверхневі білки) - спектрин (поверхневий, основний білок цитоскелету еритроцитів), гликофорин (інтегральний, фіксує спектрин на поверхні),
До даної функції можна віднести участь у створенні органел - рибосоми.
Всі ферменти є білками. Але разом з тим, є експериментальні дані про існування рибозимов, тобто рибонуклеїнової кислоти, яка має каталітичної активністю.
Регуляцію і узгодження обміну речовин в різних клітинах організму здійснюють гормони. Частина з них є білками, наприклад, інсулін і глюкагон.
Ця функція полягає у виборчому зв'язуванні гормонів, біологічно активних речовин і медіаторів на поверхні мембран або всередині клітин.
Тільки білки здійснюють перенесення речовин в крові. наприклад, ліпопротеїни (перенесення жиру), гемоглобін (транспорт кисню), трансферин (транспорт заліза) або через мембрани - Na +, К + -АТФаза (протилежний трансмембранний перенос іонів натрію і калію), Са 2+ -АТФаза (викачування іонів кальцію з клітини).
Як приклад депо білка можна привести виробництво і накопичення в яйці яєчного альбуміну. У тварин і людини таких спеціалізованих депо немає, але при тривалому голодуванні використовуються білки м'язів, лімфоїдних органів, епітеліальних тканин і печінки.
Існує ряд внутрішньоклітинних білків, призначених для зміни форми клітини і руху самої клітини або її органел (тубулін. Актин. Міозин).
Захисною функцією при інфекціях володіють імуноглобуліни крові, при пошкодженні тканин - білки системи згортання крові. Механічний захист і підтримку клітин здійснюють протеоглікани.
Білок - це послідовність амінокислот, пов'язаних один з одним пептидними зв'язками.
Легко уявити, що кількість амінокислот може бути по-різному: від мінімум двох до будь-яких розумних величин. Біохіміки домовилися вважати, що якщо кількість амінокислот не перевищує 10, то таке з'єднання називається пептид; якщо від 10 до 40 амінокислот - поліпептид. якщо більше 40 амінокислот - білок.
Лінійна молекула білка, що утворюється при з'єднанні амінокислот в ланцюг, є первинною структурою. Образно її можна порівняти зі звичайною ниткою на яку навішені до декількох сотень намистин двадцяти різних кольорів (по числу амінокислот).
Послідовність і співвідношення амінокислот в первинній структурі визначає подальшу поведінку молекули: її здатність згинатися, згортатися, формувати ті чи інші зв'язки всередині себе. Форми молекули, що створюються при згортанні, послідовно можуть приймати вторинний, третинний і четвертинний рівень організації.
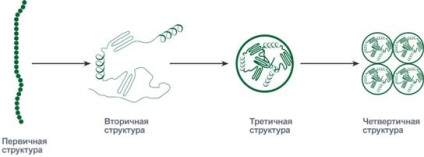
Схематичне уявлення послідовності
укладання білків в четвертинних структуру
На рівні вторинної структури білкові "намиста" здатні укладатися у вигляді спіралі (подібно дверний пружині) і у вигляді складчастого шару. коли "намиста" укладені змійкою і віддалені частини бус опиняються поруч.
Укладання білка у вторинну структуру плавно переходить до формування третинної структури. Це окремі глобули, в яких білок укладений компактно, у вигляді тривимірного клубка.
Деякі білкові глобули існують і виконують свою функцію не поодинці, а групами по дві, три і більше штук. Такі групи утворюють четвертинних структуру білка.
Об'єднання амінокислот через пептидні зв'язки створює лінійну поліпептидний ланцюг, яка називається первинною структурою білка.
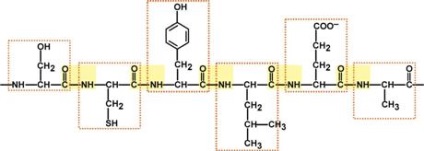
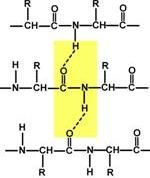
Ділянка білкової ланцюга довжиною в 6 амінокислот (Сер-Цис-Тир-Лей-Гли-Ала)
(Пептидні зв'язку виділені жовтим кольором, амінокислоти - червоною рамкою)
Первинна структура білків, тобто послідовність амінокислот в ньому, програмується послідовністю нуклеотидів в ДНК. Випадання, вставка, заміна нуклеотиду в ДНК призводить до зміни амінокислотного складу і, отже, структури синтезованого білка.
Якщо зміна послідовності амінокислот носить не летальний характер, а пристосувальний або хоча б нейтральний, то новий білок може передатися у спадок і залишитися в популяції. В результаті виникають нові білки зі схожими функціями. Таке явище називається поліморфізм білків.
Наприклад, при серповидноклеточной анемії в шостому положенні # 946; -ланцюга гемоглобіну відбувається заміна глутамінової кислоти на валін. Це призводить до синтезу гемоглобіну S (HbS) - такого гемоглобіну, який в дезоксіформ полимеризуется і утворює кристали. В результаті еритроцити деформуються, набувають форму серпа (банана), втрачають еластичність і при проходженні через капіляри руйнуються. Це в підсумку призводить до зниження оксигенації тканин і їх некрозу.
Послідовність і співвідношення амінокислот в первинній структурі визначає формування вторинної. третинної і четвертинної структур.
Вторинна структура білка - це спосіб укладання поліпептидного ланцюга в більш компактну структуру, при якій відбувається взаємодія пептидних груп з утворенням між ними водневих зв'язків. Формування вторинної структури викликано прагненням пептиду прийняти конформацію з найбільшою кількістю зв'язків між пептидними групами. Тип вторинної структури залежить від стійкості пептидного зв'язку, рухливості зв'язку між центральним атомом вуглецю і вуглецем пептидного групи, розміром аминокислотного радикала.
Усе зазначене укупі з амінокислотною послідовністю згодом призведе до строго певної конфігурації білка.
Можна виділити два можливі варіанти вторинної структури: # 945; -спіраль (# 945; -Структура) і # 946; -складчатий шар (# 946; -Структура). В одному білку, як правило, присутні обидві структури, але в різному частковому співвідношенні. У глобулярних білках переважає # 945; -спіраль, в фібрилярних - # 946; -Структура.
Вторинна структура утворюється тільки за участю водневих зв'язків між пептидними групами: атом кисню однієї групи реагує з атомом водню другий, одночасно кисень другий пептидного групи зв'язується з воднем третьої і т.д.