АЦЕТОН (від латинського acetum - оцет) (2-пропанон, диметилкетон) СН3 СОСН3. молекулярна маса 58,079; летюча безбарвна рідина з характерним запахом; температура плавлення - 94,6 ° С, температура кипіння 56,1 ° С; d4 20 0,7920, nD 20 1,3588; 0,36 мПа * с (10 ° С), 0,30 мПа * с (30 С); 0,0237 Н / м (20 ° С); tкріт 235,5 ° С, pкріт 4,75 МПа; З ° р 749,3 Дж / (кмоль * К); H ° ісп 29,1 кДж / моль (56,1 ° С), Н ° сгор -1787кДж / моль, Н ° обр - 216,5 кДж / моль ( газ; 25 ° С) і - 248 кДж / моль (рідина). Змішується з водою і органічне розчинниками, наприклад ефіром, метанолом, етанолом, складними ефірами. АЦЕТОН володіє всіма хімічний властивостями, характерними для аліфатіч. кетонів. Утворює кристалічні. з'єднання з гідросульфітом лужних металів, наприклад з NaHSO3 - (CH3) 2 C (OH) SO3 Na. Тільки сильні окислювачі, наприклад лужний розчин КМnО4 і хромова кислота, окислюють АЦЕТОН до оцтової та мурашиної кислоти і далі - до СО2 і води. Каталітично відновлюється до изопропанола, амальгамою Mg або Zn, а також Zn з СН3 СООН - до пінакон (СН 3) 2 С (ОН) С (ОН) (СН3) 2. Атоми водню легко заміщуються при Галогенування, нітрозірованія і т.п. Дією хлору і лугу АЦЕТОН перетворюються в хлороформ, який взаємодію з АЦЕТОН з утворенням хлоретона (СН 3) 2 С (ОН) СCl3. застосовуваного як антисептик. АЦЕТОН окисляє вторинні спирти в присутності алкоголятов Al до кетонів (реакція Оппенауера):
Вступає в альдольної конденсацію з утворенням діацетонового спирту (СН 3) 2 С (ОН) СН2 СОСН3. а також в Кротоновий конденсацію з утворенням окису мезітіла (СН 3) 2 С = СНСОСН3, Форон (СН 3) 2 С = -СНСОСН = С (СН3) 2 і мезітілена. В присутності. сильною мінеральних кислоти АЦЕТОН Алкілуючі фенол з утворенням дифенилолпропана (бісфенолу АЦЕТОН) (НОС6 Н4) 2 С (СН3) 2. приєднує ціанід-іон з утворенням ацетонциангидріна (CH3) 2 C (OH) CN. При піролізі (700 ° С) АЦЕТОН утворюються кетен СН2 -С-О і метан.
У промисловості АЦЕТОН отримують переважно так званої кумольним способом одночасно з фенолом з бензолу і пропилену через ізопропілбензол (кумол) за схемою:
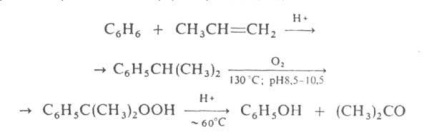
У ряді інших пром. способів синтезу АЦЕТОН виходять з изопропанола:
1. Окислення в паровій фазі (каталізатор - металеві. Сі, Ag, Ni або Pt):
Високий вихід АЦЕТОН (бл. 90%) досягається при використанні Ag, обложеного на пемзі, або срібною сітки.
2. автокаталитически окислення в рідкій фазі при 90-140 ° С і 0,2-0,3 МПа:
Вихід АЦЕТОН 95% від теоретичного, Н2 О2 87%.
3. Дегидрирование в паровій фазі в присутності ZnO, обложеної на пемзі:
Ступінь перетворюються изопропанола в АЦЕТОН при 225 ° С становить 84% при 380 ° С - 98%, при 525 ° С - 100%. Вихід АЦЕТОН близько 90%.
Новий пром. спосіб отримання АЦЕТОН - пряме окислення пропілену в рідкій фазі в присутності PdCl2 в середовищі водного розчину солей Pd, Fe або Сі при 50-120 ° С і 5-10 МПа:
Вихід АЦЕТОН 90%. Деяке значення зберіг спосіб отримання АЦЕТОН бродінням крохмалю під впливом бактерій Bacyllus acetobutylicus, що перетворюють крохмаль в АЦЕТОН і бутанол (так званої ацетонове бродіння). Відомі і ін. Способи отримання:
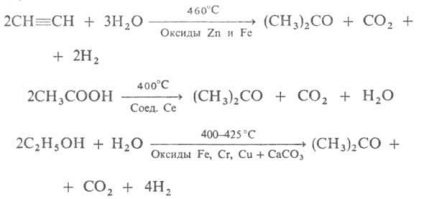
Старий пром. метод отримання АЦЕТОН-суха перегонка (СН3 СОО) 2 Са - втратив значення.
Для якостей. визначення АЦЕТОН використовують кольорові реакції, наприклад з динітробензол, нитропруссидом Na (реактив легальний); для ідентифікації - кристалічні. похідні А. наприклад семікарбазон (температура плавлення 187 ° С). Кількісно АЦЕТОН визначають: 1) оксімірованіем:
утворюється НCl титрують лугом; 2) титруванням розчином КМnО4 в лужному середовищі (при цьому АЦЕТОН окислюється до СО2 і Н2 О). АЦЕТОН - широко застосовуваний розчинник органічне речовин, в першу чергу нітратів і ацетатів целюлози; завдяки порівняно малої токсичності він використовується також в харчова і фармацевтичних. промисловості; АЦЕТОН служить також сировиною для синтезу оцтового ангідриду, кетена, діацетонового спирту, окису, мезітіла, метилізобутилкетону, метилметакрилату, дифенилолпропана, ізофорон і багатьох ін. З'єднань. Світове виробництво АЦЕТОН ок. 3 млн. Т / рік (1980).
Для АЦЕТОН т. Доп. -20 ° С, т. Самовоспл. 500 ° С; КПВ 2,15-13,00%. АЦЕТОН при вдиханні накопичується в організмі. Так як виводиться з організму повільно, можливі хронич. отруєння. ГДК 200 мг / м 3.
Хімічна енциклопедія. Том 1 >> До списку статей