ВАНАДІЮ оксиду
ВАНАДІЮ оксиду. Характеристики найбільш важливих ВАНАДІЮ оксиду о. представлені в таблиці. Зі збільшенням ступеня окислення V посилюються кислотні властивості оксидів, а також їх хімічний стійкість. Для багатьох ВАНАДІЮ оксиду о. характерні досить широкі області гомогенності (див. табл. та рис.).
Монооксид VO не розчинний у воді; з розведеним неорганічне кислотами утворює блідо-блакитні або фіолетові розчини солей V (II). Сильний відновник. Отримують відновленням V2 O5 воднем при 1700 ° С. Гідроксид V (OH) 2. утворюється при дії лугів на розчин солей V (II), в індивідуальному вигляді не отримана.
Сесквіоксід V2 O3 існує в двох кристалічних. модифікаціях; при - 105 ° сформуйте перетворюються в (переходу 1,8 кДж / моль) .Форма - антиферромагнетик, температура Нееля 168 К. У воді не розчин .; з неорганічне кислотами утворює солі V (III). Сильний відновник. Отримують відновленням V2 O5 оксидом вуглецю, Н2. S і ін. При нагріванні. Застосовують для отримання ванадієвих бронз, як матеріал для термісторів. Зустрічається в природі у вигляді мінералу кареліаніта. Гідроксид V (OH) 3 утворюється при дії лугів або NH4 OH на розчини солей V (III) без доступу повітря.
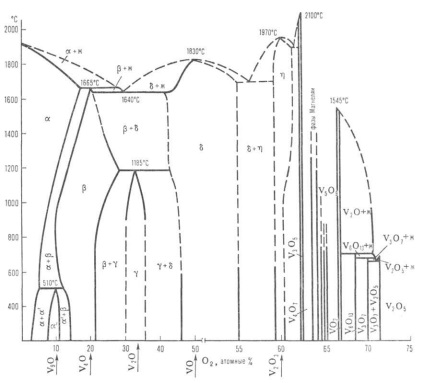
Діаграма стану системи ванадій-кисень: Ж-розплав; -тверді розчини (-О2 в V; -на основі V9 O; -на основі V4 O; -на основі V2 O; -на основі VO; -на основі V2 Оз); пунктирними лініями позначені приблизні межі фаз.
Пентаоксид тріванадія V3 O5 - антиферромагнетик, температура Нееля 270 К; при 430 К набуває металеві. провідність.
Діоксид VO2 існує в двох кристалічних. модифікаціях; при 68 ° сформуйте перетворюються в (переходу 3,1 кДж / моль) .Форма - антиферромагнетик, температура Нееля 345 К. Чи не розчинний у воді. Гігроскопічний. Амфотерен: в кислих розчинах утворює катіон ванадію VO 2 + (розчин набуває світло-синього забарвлення), в лужних дає ванадати (IV) - солі не виділеної у вільний стані ізополіванадіевой (IV) кислоти H2 V4 O9. Восстановитель. Окислюється на повітрі. Отримують сплавом V2 O5 зі щавлевої кислотою, нагріванням без доступу повітря суміші V2 O3 з V2 O5. окисленням V2 O3. Застосовують у виробництві ванадієвих бронз, як напівпровідниковий матеріал для термісторів, перемикачів елементів пам'яті, дисплеїв і ін.
Оксігідроксід VO (OH) 2 - рожеві кристали; осідає з розчинів при рН> 4. амфотерен.
Пентаоксид діванадія V2 O5 вище 700 ° С дисоціюють. Діамагнетик. Напівпровідник n-типу; ширина забороненої зони
2,5 еВ. Розчинність в воді 0,35 г / л при 25 ° С; у водних розчинах існує у вигляді ізополіванадіевой (V) кислоти ймовірного складу H2 [O (V2 O5) 2,5]. B кислих розчинах ймовірні - форми існування V (V) - іони VO2 + і VO 3+. При нагріванні таких розчинів (рН 1-2) виділяються гідрати змінного складу V2 O5 * xH2 O. В лужних розчинах утворюються ванадати (V). Про виробництво технічного V2 O5 см. Ванадій. Чистий V2 O5 отримують розкладанням NH4 VO3 при 400-500 ° С з наступною витримкою в струмені О2. гідролізом VOCl3. Пентаоксид - проміжні продукт у виробництві феррованадия, ванадію, ванадатов і ін. З'єднання V; каталізатор при отриманні H2 SO4; компонент спец. стекол, глазурі і люмінофорів червоного світіння. Зустрічається в природі у вигляді мінералу щербінаіта.
Властивості ОКСИДІВ ВАНАДІЮ
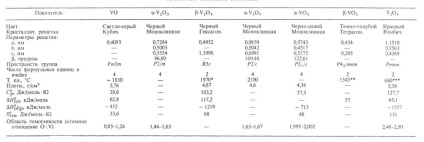
* Температура кипіння - 3000 ° С (з різні). ** Температура кипіння
Відомі п'ять ВАНАДІЮ оксиду о. утворюють гомологічен. ряд Vn O2n-1 (фази Магнеллі), де і = 4-8. Являють собою чорні кристали з триклинной гратами. Мають металеві. провідність при низьких температурах (крім V7 O13). Антиферомагнетики. М. б. використані як напівпровідникові матеріали для терморезисторов. Ванадій утворює також оксиди V3 O7 і V6 O13 - чорні кристали з моноклінної гратами, що плавляться інконгруентно: перший - при 660-680 ° С з утворенням V6 O13. другий - при 700-710 ° С з утворенням VO2. ВАНАДІЮ оксиду о. токсичні. Для V2 O5 ГДК 0,1 мг / м 3 (дим), 0,5 мг / м 3 (пил).
Хімічна енциклопедія. Том 1 >> До списку статей