Основні білки м'язів
Серед білків м'язової тканини виділяють три основні групи: саркоплазматическим білки, на частку яких припадає близько 35%, миофибриллярних білки, які становлять близько 45%, і білки строми, кількість яких досягає 20%.
Саркоплазматическим білки розчиняються у воді і слабких сольових розчинах. Основну масу їх складають білки-ферменти. локалізовані головним чином в мітохондріях і каталізують процеси окисного фосфорилювання, а також багато ферментів гліколізу. азотистого і ліпідного обмінів, що знаходяться в саркоплазме. До цієї групи належить також білок міоглобін, який зв'язує кисень з великим спорідненістю, ніж гемоглобін, і депонує молекулярний кисень в м'язах. Останнім часом відкрита група саркоплазматических білків парвальбумін, які здатні зв'язувати іони кальцію, однак їх фізіологічна роль залишається не з'ясованим.
Миофибриллярних білки включають скоротливі білки міозин, актин і актоміозін, а також регуляторні білки тропомиозин, тропонин, α- і β-актініни. Миофибриллярних білки забезпечують скоротливу функцію м'язів.
Міозин є одним з основних скорочувальних білків м'язів і становить близько 55% загальної кількості м'язових білків. З нього складаються товсті нитки (філаменти) міофібрил. Молекулярна маса цього білка - близько 470 000. У молекулі міозину розрізняють довгу фибриллярную частина і глобулярні структури (головки). Фібрилярна частина молекули міозину має двуспіральную структуру (рис. 5).
У складі молекули виділяють шість субодиниць: дві важкі поліпептидні ланцюга (молекулярна маса 200 000) і чотири легкі ланцюги (молекулярна маса 1500-2700), розташовані в глобулярної частини. Основною функцією фибриллярной частини молекули міозину є здатність утворювати добре впорядковані пучки миозинових филаментов або товсті протофібрілли (див. Рис. 5). На голівках молекули міозину розташовані активний центр АТФ-ази та актінсвязивающій центр, тому вони забезпечують гідроліз АТФ і взаємодія з Актинові філаменти.
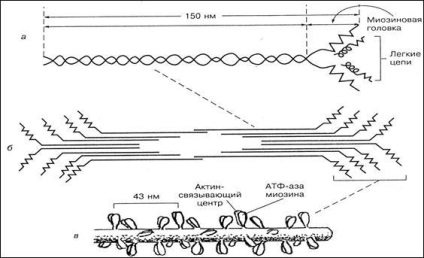
Мал. 5. Схема будови молекули міозину (а), миозинового пучка (б)
і міозіновой товстої нитки (в)
Молекула міозину містить значну кількість глутамінової амінокислоти і має великий негативний заряд, що підсилює зв'язування вільних іонів Са 2+ і Мg 2+. У присутності іонів Са 2+ підвищується АТФ-азная активність міозину і швидкість гідролізу АТФ відповідно до рівняння
Хімічна енергія АТФ, що звільняється в ході даної ферментативної реакції, використовується для зміни конформації білка міозину і генерації напруги між товстими і тонкими нитками міозину в скорочується м'язі. За допомогою іонів Mg 2+ міозин здатний приєднувати молекули АТФ і АДФ, а також взаємодіяти з молекулами актину, що знаходяться в складі тонких ниток міофібрил.
Актин - другий скоротливий білок м'язів, який становить основу тонких ниток (рис. 6). Відомі дві його форми - глобулярний G-актин і фібрилярний F-актин. Глобулярний актин - це кулястий білок з молекулярною масою 42 000. На його частку припадає близько 25% загальної маси м'язового білка.
У присутності Мg 2+ актин піддається Нековалентні полімеризації з утворенням нерозчинного філамента у вигляді спіралі, що отримав назву F-актин. Обидві форми актину не володіють ферментативною активністю. Кожна молекула G-актину здатна зв'язувати один іон Ca 2+. який грає важливу роль в ініціюванні скорочення. Крім того, молекула G-актину міцно пов'язує одну молекулу АТФ або АДФ. Зв'язування АТФ G-актином зазвичай супроводжується його полімеризацією з утворенням F-актину і одночасним розщепленням АТФ до АДФ і фосфату. АДФ залишається пов'язаної з фібрилярні актином. Процес полімеризації актину можна описати таким рівнянням:
F-актин активує АТФ-азу міозину, що створює рушійну силу процесу скорочення.
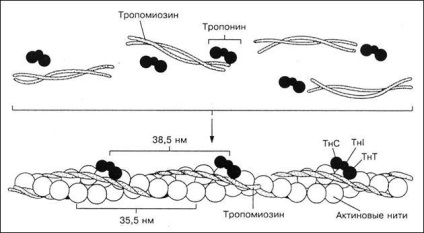
Мал. 6. Схема будови актиновой, або тонкої нитки
Актин здатний взаємодіяти з міозином, утворюючи актоміозіновий комплекс. Молярне співвідношення актину і міозину в актомиозинового комплексі - приблизно 1: 1. Нитка F-актину може зв'язувати велику кількість молекул міозину. Істотною властивістю актомиозинового комплексу є дисоціація його в присутності АТФ і Мg 2+.
До складу тонких ниток поряд з актином входять і інші мінорні білки - тропомиозин, тропоніни, актініни.
Тропомиозин (Тм) - це структурний білок актиновой нитки, що представляє собою витягнуту у вигляді тяжа молекулу. Дві його поліпептидні ланцюга як би обвивають Актинові нитки (див. Рис. 6). На кінцях кожної молекули тропомиозина розташовані білки тропоніновим системи, наявність якої характерно тільки для поперечно-смугастих м'язів.
Тропонин (Тн) є регуляторним білком актиновой нитки. Він складається з трьох субодиниць - ТНТ, ТнI і ТНС. Тропонин Т (ТНТ) забезпечує зв'язування цих білків з тропоміозіном. Тропонин I (ТнI) блокує (пригнічує) взаємодія актину з міозином.
Тропонин С (ТНС) - це Са 2+ - зв'язуючий білок, структура і функції якого подібні широко поширеній в природі білку кальмодуліном. Тропонин С, як і кальмодулін, пов'язує чотири іона Са 2+ на молекулу білка і має молекулярну масу 17 000. У присутності Са 2+ змінюється конформація тропонина С, що призводить до зміни положення Тн по відношенню до актину, в результаті чого відкривається центр взаємодії актину з міозином.
Таким чином, тонкий филамент міофібрили поперечно-смугастої м'язи складається з F-актину, тропомиозина і трьох тропоніновим компонентів - ТНС, ТнI і ТНТ. Крім цих білків, в м'язовому скороченні бере участь білок актінін. Виявляється він в зоні Z-лінії, до якої кріпляться кінці F-актінових молекул тонких ниток міофібрил.
Білки м'язової строми скелетної м'язі представлені в основному колагеном і еластином, які входять до складу сарколеми і Z-ліній міофібрил. Ці білки мають еластичність, великий пружністю, що має істотне значення для процесу скорочення і розслаблення м'язи.
Небілкові компоненти м'язів
До складу сухого залишку м'язів поряд з білками входять і інші речовини, серед яких виділяють азотсодержащие, безазотистих екстратівние речовини і мінеральні речовини.
До азотовмісних речовин скелетних м'язів відносяться АТФ і продукти її розщеплення - АДФ і АМФ, а також креатинфосфат, креатин, креатинін, карнозин, ансерін, вільні амінокислоти та ін.
АТФ, що міститься в кількості 0,25-0,40%, і креатинфосфат, кількість якого коливається в межах 0,4-1,0%, є джерелами енергії м'язового скорочення. Продукти їх розпаду - АДФ, АМФ і креатин - надають регулюючу дію на обмін речовин в м'язах. Карнозин є дипептидом і бере участь в перенесенні фосфатних груп, стимулює роботу іонних насосів, збільшує амплітуду м'язового скорочення, які знижуються при втомі і цим сприяють відновленню працездатності. Карнітин бере участь в перенесенні жирних кислот - важливих енергетичних джерел - через мембрани мітохондрій і тим самим сприяє їх окислення і енергоутворення.
До складу різних клітинних мембран м'язової тканини входить ряд азотовмісних фосфоліпідів: фосфатидилхолін (лецитин), фосфатидилетаноламін (Кефалінія), фосфатидилсерин і ін. Фосфоліпіди беруть участь в обмінних процесах, будучи постачальниками холіну і жирних кислот - субстратів тканинного дихання. Інші азотовмісні речовини - сечовина, сечова кислота, пуринові основи (аденін, гуанін) - є проміжними або кінцевими продуктами азотистого обміну і зустрічаються в м'язах в невеликих кількостях.
До безазотистих сполук м'язової тканини відноситься глікоген, який знаходиться в саркоплазме у вільному або зв'язаному з білками стані і використовується в м'язах як основний енергетичний субстрат при напруженій роботі. Кількість його в залежності від харчового раціону харчування і ступеня тренованості коливається від 0,3 до 3,0% загальної маси м'язів. При тренуванні збільшується головним чином кількість вільного глікогену.
У м'язі міститься ряд проміжних продуктів обміну вуглеводів - гексозофосфат, піровиноградна і молочна кислоти.
З ліпідів в м'язової тканини виявляються тригліцериди у вигляді крапельок жиру, а також холестерин.
Мінеральні речовини складають 1-1,5% загальної маси м'яза. Склад їх різноманітний. Основними катіонами є Na +. До +, Mg 2+. Са 2+. Катіони До + зосереджені в основному усередині м'язових волокон, а Na + - переважно в міжклітинної рідини. Вони беруть участь в процесах збудження м'язів, запуск їх скорочення. Серед аніонів переважають Сl -. Н2 РО4 -. НРО4 2. SO4 2-. НСО3 -.
У м'язової тканини міститься ряд мікроелементів: кобальт, залізо, нікель, бор, цинк і ін. Вони є або структурними компонентами складних білкових молекул, або активаторами ферментів. Всі мінеральні речовини відіграють важливу роль в регуляції різних біохімічних процесів в м'язах.