ГЛАВА 3. інфекційно-запальні захворювання стравоходу
1. Чи є виявлення Candida при цитологічному дослідженні тканин, отриманих шляхом щіткової біопсії (браш-біопсії), діагностичним критерієм моніліального (кандидозного) езофагіту?
Гриби роду Candida ставляться до сапрофітним мікроорганізмам шлунково-кишкового тракту людини. Для підтвердження інфекційного захворювання при дослідженні зразків тканин, отриманих шляхом змивів зі слизової оболонки стравоходу або щіткової біопсії, необхідно виявити міцеліальні форми гриба, а також отримати докази грибкової інвазії за допомогою звичайної біопсії тканин (див. Малюнки).
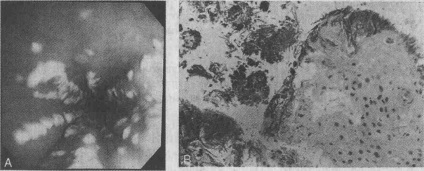
А. Ендоскопічна картина кандидозного езофагіту. Перлинно-білий ексудат з гіперемією слизової оболонки. В. Гістологічна картина гіф, що дозволяє припустити наявність кандидозної інфекції
2. Чи є медікаметозное терапія, спрямована на зменшення кислотності шлункового соку, фактором розвитку моніліального (кандидозного) езофагіту у пацієнтів з нормальним імунним статусом?
У пацієнтів, які приймають блокатори Н2-рецепторів гістаміну, з більшою частотою виявляється підтверджена бактеріологічним методом колонізація в стравоході грибів роду Candida, що є фактором розвитку езофагіту.
3. Чи необхідно проведення загального противогрибкового лікування кандидозного езофагіту у хворих зі СНІДом?
Незважаючи на те що хворим з порушеннями імунного статусу рекомендується призначення системних протигрибкових препаратів, до складу яких входить імідазол (наприклад, флюконазол, 100-200 мг / день всередину, або кетоконазол, 400-800 мг / день всередину), більш доцільним є проведення місцевою терапії. Застосування вагінальних таблеток з клотримазолом всередину (по 100 мг 3 рази на день протягом тижня) у хворих зі СНІДом виявилося успішним при лікуванні езофагіту в переважній більшості випадків.
4. Який метод лікування слід застосовувати в першу чергу у пацієнтів з гранулоцитопенією і підтвердженим моніліального кандидозним езофагітом?
У зв'язку з високим ризиком дисемінації грибкової інфекції у пацієнтів з гранулоцитопенією їм слід призначати внутрішньовенно амфотерицин В. Дозування і тривалість лікування визначаються клінічним перебігом захворювання у кожного конкретного хворого. Лихоманить пацієнтам з поширеним езофагітом або іншими ознаками вісцерального грибкового ураження препарат призначається в дозі 0,5 мг / кг маси тіла в день. У хворих без лихоманки і з незначним ураженням слизових оболонок доза може бути зменшена до 0,3 мг / кг.
5. Чи дозволяє комбінована терапія амфотерицином В і похідними імідазолу (наприклад, флюконазолом) більш успішно пригнічувати патологічний процес при лікуванні грибкового езофагіту?
Незважаючи на те що при комбінованому застосуванні деяких антибіотиків (наприклад, 5-фторцітозіна, тетрацикліну, рифампіну) з амфотерицином В терапевтичні можливості зростають, це не поширюється на препарати імідазольного ряду. При одночасному застосуванні амфотерицин В і препарати імідазольного ряду діють як антагоністи, що робить цю комбінацію препаратів небажаної.
6. Чи мають біопсія слизової оболонки і цитологічне дослідження мазків (щеточная біопсія) однаковою чутливістю при діагностиці уражень стравоходу вірусом простого герпесу (ВПГ) і цитомегаловірусом (ЦМВ)?
Хоча біопсія слизової оболонки стравоходу і цитологічне дослідження мазків в рівній мірі ефективні при діагностиці ВПГ-інфекції, дослідження мазків рідко виявляється корисним при діагностиці ЦМВ-інфекції. ЦМВ вражає фібробласти підслизового шару і клітини ендотелію судин, тому біопсію слід брати з центру виразки. ВПГ вражає клітини плоского епітелію, тому для гістологічної верифікації діагнозу досить дослідження клітин епітелію і біопсії слизової з краю виразки. Зішкріб слизової і шматочок матеріалу біопсії необхідно також помістити в спеціальну культуральну середу, оскільки вірусологічне дослідження є більш чутливим методом, ніж обидва вищевказані.
7. Чи можлива диференціальна діагностика ВПГ- і ЦМВ-езофагіту тільки на основі ендоскопічної картини?
Так, можлива. На ранніх стадіях інфікування наявність того чи іншого вірусу може бути імовірно встановлено по деяких особливостей ендоскопічної картини. На ранніх стадіях інфікування ВПГ з'являються типові везикули (такі ж, як при ураженні носогубній області), на місці яких потім формуються обмежені виразки до 0,5-2,0 см в діаметрі, з піднятими над поверхнею слизової оболонки гранулярними жовтуватими краями - так звані кратероподібної виразки. На ранніх стадіях ЦМВ-інфекції виявляються лінійні серпоподібні виразки в середній і нижній третині стравоходу. Одночасне інфікування ВПГ і ЦМВ описано у осіб з порушеннями імунного статусу.
8. При ураженні стравоходу яким з трьох вірусів герпесу з'являються внутрішньоклітинні тільця Кодрі (Cowdry) типу А і матове забарвлення ядер?
Характерною рисою ВПГ-езофагіту є наявність гігантських багатоядерних клітин, балонної дегенерації епітеліальних клітин, маргінація хроматину і матових ядер. Тельця Кодрі типу А в ядрах клітин - патогномонічний ознака ВПГ-інфекції.
При діагностиці ЦМВ-інфекції гістологічні методи дослідження мають меншою чутливістю, ніж при діагностиці ВПГ-інфекції. В 2-40% випадків діагноз ставиться при проведенні світлової мікроскопії. Якщо в соскобе слизової оболонки присутні тільки епітеліальні клітини, ЦМВ-інфекцію виключити не можна, так як дослідження тканини не було проведено належним чином. Типовими гістологічними ознаками ЦМВ-інфекції є великі клітини, що містять цитоплазматичні і амфофільние внутрішньоядерні включення. Застосування імуногістохімічних методів і методу гібридизації in situ для виявлення ДНК ЦМВ підвищує діагностичну чутливість тканинної біопсії. Культивування вірусів (вірусологічесій метод) залишається стандартним методом діагностики ВПГ- і ЦМВ-інфекції.
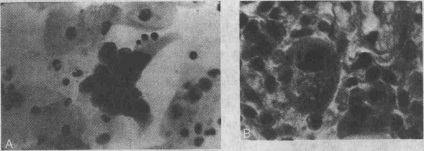
А. Цитологічний мазок, який ілюструє внутрішньоядерні включення Кодрі типу А, що представляють собою вірус простого герпесу. В. Гістологічний препарат, який ілюструє як цитоплазматические, так і внутрішньоядерні включення, що представляють собою цитомегаловірус
9. Яким вірусом, ВПГ або ЦМВ, частіше викликається дистальний виразковий езофагіт у хворих СНІД ом?
При наявності назолабіальний (носо-губних) поразок діагноз ВПГ очевидний, проте відсутність шкірних висипань не дозволяє виключити езофагіт, викликаний ВПГ. Що стосується хворих на СНІД, то у них ЦМВ частіше вражає праву половину ободової кишки (викликаючи виразковий коліт), ніж стравохід. У пацієнтів, які перенесли трансплантацію кісткового мозку і які отримують імуносупресивну терапію, і хворих з лейкозом поразки стравоходу ВПГ і ЦМВ зустрічається однаково часто. Хоча при ВПГ-інфекції можлива дисемінація процесу, вона розвивається рідше, ніж при ЦМВ-інфекції, для якої велике ураження внутрішніх органів є радше правилом.
10. Для інфікування якими з перелічених мікроорганізмів найбільш характерно одночасне поява великих плоских виразок овоидной форми і сероконверсия ВІЛ?
У хворих на СНІД потенційними причинами виникнення інфекційних виразок стравоходу є гриби роду Candida, ВПГ і ЦМВ. Ранні стадії інфекційного процесу і сероконверсия з появою антитіл до ВІЛ рідко супроводжуються розвитком опортуністичних (викликаних умовно-патогенною мікрофлорою) інфекцій. Описано багато випадків утворення гігантських виразок, пов'язаних з ВІЛ-інфекцією, що характеризуються тими ж симптомами, що й інші інфекційні ураження стравоходу. Як правило, при звичайній біопсії, щіткової біопсії і посіві тканин слизової оболонки мікроорганізми, зазвичай присутні у пацієнтів з порушеннями імунного статусу, виявити не вдається. При електронній мікроскопії матеріалу біопсії, отриманого з краю виразки, виявлялися частки ВІЛ. Є повідомлення про швидке загоєння таких виразок при призначенні кортикостероїдних гормонів.
11. Як часто зустрічаються бактеріальні ураження стравоходу?
У дослідженні Уолша (Walsh) і співавт. 33 пацієнтам була проведена біопсія слизової оболонки стравоходу; у 19 з них діагностовано інфекційний езофагіт. У 2 пацієнтів з 19 (11%) були ознаки бактеріального езофагіту. При патоморфологічної дослідженні осіб з порушеннями імунного статусу у 20 з 123 пацієнтів (16%) виявлено ознаки бактеріального езофагіту.
12. Чи можна ставити діагноз бактеріального езофагіту при виявленні грибів або вірусів в ділянках тканин, заборонених при біопсії слизової оболонки?
Суворі критерії бактеріального езофагіту виключають можливість супутнього вірусного, грибкового або неопластического ураження стравоходу. Для верифікації діагнозу бактеріального езофагіту необхідно, щоб на препаратах, забарвлених за Грамом, були ознаки бактеріальної інвазії слизової оболонки. Для виключення грибкової інфекції використовується фарбування препаратів за Шиффа і по Гоморі метанаміном срібла. Негативні результати культивування ВПГ і ЦМВ, а також відсутність вірусних включень (тілець) під час гістологічного дослідження дозволяють виключити вірусну етіологію захворювання.
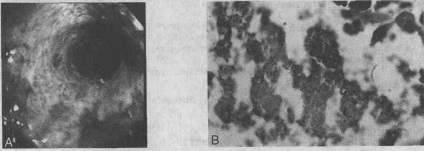
А. Ендоскопічна картина гнійного езофагіту, для якої характерні дифузний слизовий ексудат, набряк слизової оболонки з утворенням булл і поява Цианотична фарбування. В. При фарбуванні слизової оболонки стравоходу за Брауном-Хопс (Brown-Hopps) виявляються множинні грампозитивнімікроорганізми, розташовані на її поверхні
13. Які мікроорганізми найчастіше є причиною розвитку бактеріального езофагіту?
В даний час великого поширення набула теорія, згідно з якою найбільш частою причиною виникнення езофагіту є мікрофлора ротоглотки. При фарбуванні препарату по Брауну-Хопс найчастіше виявляються коки, а також змішана мікрофлора (коки в поєднанні з грамнегативними паличками). Рідше виявляються грамнегативні палички і вже зовсім рідко - грампозитивні палички. Пацієнтам з підозрою на бактеріальний езофагіт показано виконання бактеріального посіву крові. Бактериемия і сепсис - досить часті стану при бактеріальному езофагіті, а ідентифікація збудника дозволяє проводити цілеспрямовану антимікробну терапію.
14. Чи може Mycobacterium tuberculosis бути причиною розвитку виразкового езофагіту?
15. Чи можна встановити діагноз хвороби Шагаса (Chagas) на підставі результатів манометр стравоходу і гістологічного дослідження біоптатів глибоких шарів слизової оболонки дистального відділу стравоходу?
Причиною розвитку хвороби Шагаса є Trypanosoma cruzi, ендемічний для Південної Америки мікроорганізм, який вражає клітини нервових гангліїв, залучаючи тим самим до патологічного процесу багато органів. Поразка стравоходу при цьому нагадує ахалазію, однак тиск НСС не тільки не підвищено, а, навпаки, залишається низьким. У типових випадках симптоми захворювання з'являються через роки і навіть десятиліття після епізоду гострої інфекції. Для постановки діагнозу хвороби Шагаса необхідна наявність типових змін при манометр стравоходу, позитивних серологічних реакцій і ознак залучення в патологічний процес внутрішніх органів. Біопсія слизової оболонки стравоходу не має діагностичного значення. При хвороби Шагаса стравохід більш чутливий до впливу нітратів та блокаторів кальцієвих каналів, які покращують його спорожнення. На відміну від первинної ахалазии, хвороби Шагаса часто супроводжують ураження серця, нирок, кишечника і жовчних шляхів.
16. Чи доцільно емпіричне лікування інфекційного езофагіту у пацієнтів з дисфагією і порушеннями імунного статусу?
Дисфагія - основне ускладнення, що розвивається практично у всіх пацієнтів з інфекційним езофагітом, незалежно від його етіології. У хворих з кандидозом ротової порожнини або ознаками носогубній ВПГ-інфекції рішення про лікування грибкового або ВПГ-езофагіту не викликає ускладнень. У пацієнтів з порушеннями імунного статусу провідною причиною дисфагії є інфікування Candida; в цих випадках слід провести тижневий курс місцевої терапії емпірично підібраними препаратами (клотримазолом, нистатином або похідними іміди-зола). При неефективності протигрибкової терапії показано призначення Ацик-ловіра. Якщо, незважаючи на проведене лікування, симптоми езофагіту зменшаться або прогресують, доцільно виконати езофагоскопію з біопсією слизової оболонки, щеточной біопсією і посівом біоптатів.
17. Як лікувати пацієнтів з ВПГ-езофагітом?
У пацієнтів з ВПГ-езофагітом і нормальним імунітетом виразки стравоходу заживають одночасно з везикулами в носо-губної області і ротової порожнини. Незважаючи на можливість спонтанного одужання, більшість фахівців рекомендують таким пацієнтам приймати ацикловір по 200 мг всередину 5 разів на день для прискорення вирішення симптомів. Пацієнтам з порушеннями імунного статусу показано призначення ацикловіру в подвійній дозі - 400 мг 5 разів на день - або внутрішньовенне введення препарату по 250 мг / м 2 кожні 8 год. У пацієнтів з порушеннями імунного статусу ацикловір можна застосовувати з профілактичною метою для зниження ризику інфікування ВПГ . Профілактична доза становить 200 мг всередину 4-5 разів на день або 800 мг всередину 2 рази на день.
18. Як лікувати ЦМВ-езофагіт?
ЦМВ-інфекція виникає у пацієнтів з порушеннями імунного статусу при реактивації "сплячого" вірусу або в результаті гемотрансфузії і трансплантації органів. При ЦМВ-езофагіт ефективно 2 препарату. Ганцикловір можна вводити внутрішньовенно в дозі 5 мг / кг кожні 12 годин протягом 2 тижнів, потім - один раз в день протягом тижня. При розвитку у хворого гранулоцитопении або при відсутності ефекту від лікування показано застосування фоскарнет в дозі 60 мг / кг кожні 8 год протягом 2 тижнів, а потім - протягом ще 2 тижнів по 90-120 мг / кг в день.