Ініціатор катионной полімеризації є джерелом позитивно заряджених частинок, що виникають або мимовільно, або в результаті реакції з мономером або спеціально вводиться з'єднанням. Зазвичай ініціаторами служать речовини кислотного характеру: протонні і апротонних кислоти, комплекси кислот Льюїса з сполуками - донорами електронів, солі Карбонія типу Ph3 C + · SbCl6. солі оксония виду Et3 O + · SbCl6
Кислоти Льюїса - AlCl3. BF3. SnCl4. ZnCl2. TiCl4 і ін. - використовують для низькотемпературної катионной полімеризації алкенів, що приводить до утворення високомолекулярних полімерів. Зазначені кислоти зазвичай застосовують в комбінації з протонодонорнимі або іншими добавками.
Таблиця 1. Деякі катіонні ініціатори полімеризації алкенів
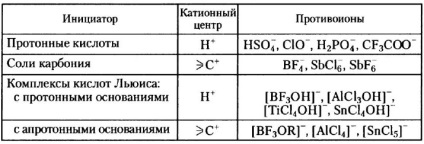
Протонні кислоти для ініціювання катионной полімеризації використовують тільки в тому випадку, якщо утворений ними аніон не відрізняється сильною нуклеофільність; в іншому випадку він утворює з протоновану мономером ковалентний зв'язок:
Через високу нуклефоільності галогенів галогенводородних кислоти не застосовують як ініціаторів катионной полімеризації. Для полімеризації деяких мономерів (наприклад, вищих ненасичених вуглеводнів, кумарону, індена) використовують фосфорну, сірчану і хлорне кислоти, хоча при цьому і отримують, як правило олігомери.
Так, ізобутилен не чутливий до сухого BF3. але миттєво полимеризуется при додаванні слідів води; активатор (вода) реагує з ініціатором з утворенням комплексу, який протонірует мономер і формує ініціюють подальше зростання ланцюга катіонні частки:
На стадії ініціювання протон приєднується до молекули мономера і утворюється іонна пара
Ця іонна пара потім реагує з наступною молекулою мономера:
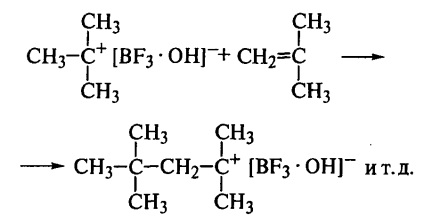
Таким чином, на кінці зростаючої ланцюга завжди знаходиться карбкатион з протівоаніоном. Завдяки поляризації молекули мономера забезпечується регулярне приєднання ланок по типу «голова до хвоста», так як інший тип приєднання тут просто неможливий. Тому ланцюг полімеру має хімічно регулярну структуру. Невисока діелектрична проникність середовища (хлоровані вуглеводні) сприяє збереженню іонної пари в процесі росту ланцюга.
У загальному випадку, процес ініціювання катионной полімеризації в присутності кислот Льюїса і активують добавок можна уявити схемами:
Що стосується таких активаторів, як алкілгалогеніду, наприклад в системі:
то освіту ініціюють катіонних частинок тут можливо тільки за участю мономера:
Принципово можливий каталіз тільки однієї кислотою Льюїса, якщо вона здатна до утворення іонної пари:
Крім зазначених вище в якості ініціаторів катионной полімеризації, можливе використання I2. Сu 2+. а також випромінювань з високою енергією. Каталітична дія йоду засноване на наступних перетвореннях:
Таким чином, НI виконує функцію активатора по відношенню до I2. Іон Сu 2+ ініціює полімеризацію або шляхом окислення π-зв'язку (перехід електрона від мономера до Сu 2+), або приєднанням по π-зв'язку.
Для солей Карбонія можливий механізм ініціювання, що складається в перенесенні електрона від мономера на катіон, з утворенням вільного радикала і катіон-радикала мономера:
Утворені за цією схемою вільні радикали відрізняються високою стабільністю і як ініціюють агенти братися до уваги не повинні.
Обрив ланцюга в катионной полімеризації має набагато більше значення, ніж в аніонів процесі. При анионной полімеризації можливе створення умов для безобривного зростання ланцюгів і тривале збереження постійної концентрації «живих» макромолекул; це дозволяє багаторазово «оживляти» процес введенням додаткових кількостей мономера і нарощувати тим самим довжину ланцюгів.
У катионной полімеризації тривалість життя активних центрів, як правило, невелика. У разі катионной полімеризації, наприклад, стиролу і ізопрену, це є основною причиною утворення продуктів зі ступенем полімеризації не вище 50. Загальною властивістю активних центрів типу -МnM + є тенденція до стабілізації шляхом відщеплення протона, захоплення будь-якого аниона або ізомеризації в більш стійке стан. Тому можливість утворення високомолекулярного полімеру при катіонному ініціювання визначається співвідношенням процесів росту і стабілізації активних центрів. Розглянемо схеми реакцій обриву і передачі ланцюга в катионной полімеризації:

Так, при полімеризації изобутилена в присутності Н + [BF3 OH] - зазначені реакції обриву і передачі ланцюга (крім (1.б)) протікають у такий спосіб:
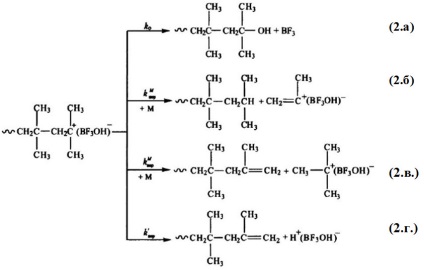
Реакції (2.б) і (2.в) кінетично невиразні, але перша призводить до утворення насиченого кінцевого фрагмента ланцюга, а друга - ненасиченого, також як і реакція (2.г). Зазначені три реакції схожі тим, що в результаті їх протікання кінетична що ланцюг не обривається, а кожна частка комплексу «ініціатор - активатор» ( «ініціатор - мономер - активатор») здатна почати зростання нового ланцюга.
Прикладом утворення ковалентного зв'язку при взаємодії з протиіоном (реакція (1.б)) є обрив ланцюга при полімеризації стиролу трифторуксусной кислотою:
Реакція передачі ланцюга на мономер не впливає на швидкість полімеризації, але сприяє регулюванню довжини полімерної макромолекули, тобто отриманню полімеру з вузьким молекулярно-масовим розподілом.
Крім передачі ланцюга на мономер можливі і реакції передачі на розчинник, домішки або спеціально вводяться речовини:
Передавачами ХА можуть бути вода, спирти, кислоти, ангідриди, прості і складні ефіри, аміни та інші сполуки.
Багато з передавачів ланцюга (вода, спирти) часто використовують як активатори, тому застосування їх в кількостях, що перевищують еквівалентну кількість по відношенню до ініціатора, може привести до зростання частки процесів передачі ланцюга і до зниження молекулярної маси.
Швидкості окремих стадій можна записати у вигляді:
Освіта іона Карбонія
Іонізаційний потенціал (енергія іонізації) I визначають як енергію, необхідну для видалення електрона з молекули або атома в газовій фазі:
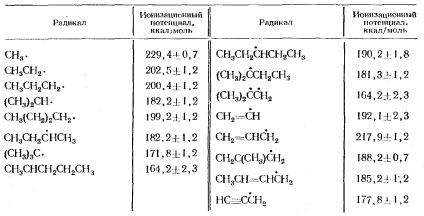
Потенціали іонізації алкільних радикалів наведені в таблиці 2.
Таблиця 2. Іонізаційні потенціали алкільних радикалів
Порівняння іонізації метильного і етільний радикалів показано на рис. 2.
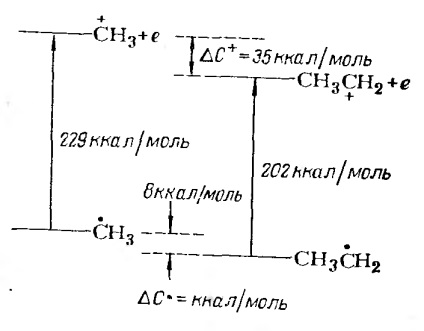
Малюнок 2. Порівняння потенціалів іонізації для метильного і етільний радикалів. Енергія стабілізації іона Карбонія # 916; С + і радикала # 916; С.
Стабілізація карбонієвого іона метильной групою становить 147 кДж / моль (35 ккал / моль), в той час, як стабілізація радикала метильной групою становить 33,6 кДж / моль (8 ккал / моль).
Спорідненість до протону
Важливо оцінити основність різних олефінів в сенсі спорідненості до протону і йону Карбонія відповідно до рівняннями:
Спорідненість олефінів до протону визначається наступними чотирма стадіями:
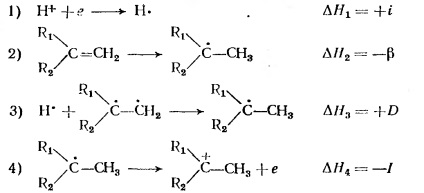
Тут i - спорідненість протона до електрону - визначається як величина, зворотна потенціалу іонізації атома водню; # 946; - енергія розкриття подвійного зв'язку; D - енергія зв'язку С - Н; I - потенціал іонізації радикала, що утворюється при приєднанні атома водню до олефину.
Для будь-якого несиметричного олефина спорідненість до протону буде залежати від того, до якого атому вуглецю він приєднується. Дані для етилену, пропілену та изобутилена наведені в таблиці 3.
Таблиця 3. Спорідненість протона і атома (ккал / моль) до олефінам
Спорідненість до іона Карбонія (С1 і С2 відповідно, як і Р1 і Р2) змінюється також як і спорідненість до протону Р1 (і відповідно С1) і значно зростає від етилену до ізобутіленом. Цим пояснюється та обставина, що реакционноспособна зростає від етилену, який не активний до катіонних катализаторам, до ізобутіленом, який має високу активність. Як видно з таблиці 3. зменшення потенціалу іонізації радикала викликає збільшення спорідненості до протону.
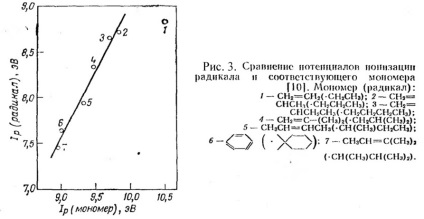
На рис 3. показано, що потенціали іонізації радикала і мономера пов'язані лінійною залежністю.
2.2.4. Зміна вільної енергії при утворенні іона Карбонія
Стабільність іона повинна бути пов'язана зі зміною вільної енергії при його утворенні.
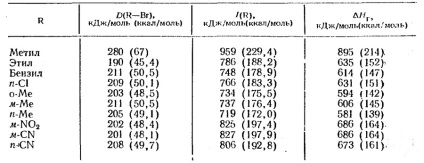
Таблиця 4. Ентальпії іонізації в газовій фазі
R - Br → R + + Br - (енергії гетеролітичні дисоціації зв'язків)
Однак, для освіти карбонієвого іонів з алкилгалогенидов в газовій фазі відомі тільки значення ентальпії, яка визначається за даними вимірювання електронного удару і, отже, є похідною енергії гетеролітичні дисоціації. Оскільки відповідні зміни ентропії невеликі, в принципі можливо оцінити зміна вільної енергії через зміну ентальпії (таблиця 4.)
Енергію, необхідну для дисоціації алкілгалогеніду RX на іони R + і X -. можна уявити як суму зміни енергії в трьох гіпотетичних стадіях:
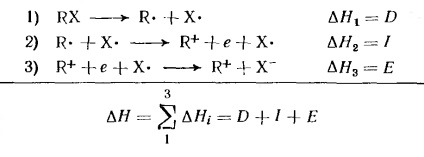
величина # 916; Н1 являє собою енергію гомолитически дисоціації зв'язку; # 916; Н2 -іонізаціонний потенціал алкільного радикала; # 916; Н3 -сродство до електрону атома Х (яке залежить від природи алкила). Іонізаційні потенціали алкільних радикалів і # 916; Н при утворенні карбонієвого іонів алкилгалогенидов дані в таблиці 4. Ці дані відносяться до повністю розділеним іонів у газовій фазі. Як видно з таблиці 4, енергія дисоціації алкільних з'єднань і іонізаційні потенціали несподівано залежать від природи R. Освіта газоподібних карбонієвого іонів шляхом гетеролиза нейтральних молекул вимагає великих витрат енергії і тому рідко спостерігається експериментально.
Органічні реакції, що включають освіту іона Карбонія в розчині, набули більшого поширення.
Реакції карбонієвого іона в розчині обов'язково включають сольватацию іонів. Взаємодія з розчинником стабілізує карбонієвого іон і його противоион. Так як стабілізація, перш за все, пов'язана з присутністю електричних зарядів, то іонізовані форми будуть краще сольватованих, ніж неіонізовані. Всі розчинники сприяють деякою сольватації (у порівнянні з газовою фазою).
Схема іонізації органічної молекули RX в газовій фазі і в розчині представлена на рис 4. на якому - перехідний стан іонізації R + і X - - розділені іони.
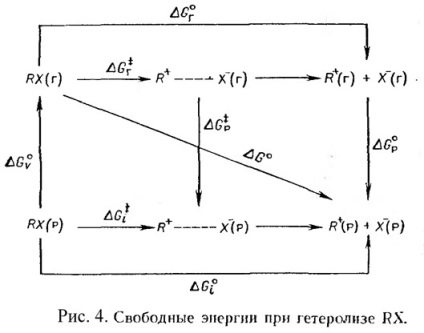
Цілком очевидно, що # 916; G 0 - стандартне зміна вільної енергії утворення іонів в розчині з газоподібного алкілгалогеніду - має виражатися сумою # 916; G 0 р + # 916; G 0 м З малюнка 4. слід:
Вільну енергію сольватації іона зазвичай розраховують по емпіричному рівнянню, часто званого рівнянням Борна. Зміна вільної енергії при переміщенні іона з радіусом r і зарядом e з газової фази в розчинник (D) дорівнює:
Відповідно до рівняння (11), енергія сольватації іона буде більше в розчинниках з високою діелектричної проникністю.
Важливе значення має також специфічна сольватация і поляризованість. Мабуть, іони маленького радіуса повинні краще сольватованих, і це дійсно справедливо для неорганічних катіонів. Звідси випливає, що найбільш сильна взаємодія між іоном і розчинником матиме місце при малому радіусі іона і великому значенні діелектричної проникності середовища.