
Країна. Франція
Час винаходу. 1859 р
Відкриття акумулюючого ефекту належить до найважливіших і найзначніших винаходів в області електротехніки. Дуже часто виникала і виникає необхідність живити електрикою прилади або механізми в такому місці, де немає джерел енергії.
Довгий час для цих цілей використовували гальванічну батарею, але вона була слабким, дорогим і надмірно громіздким джерелом струму. Створення електричного акумулятора значно спростило цю задачу.
Ще в 1802 році Ріттер відкрив, що дві мідні пластини, опущені в кислоту і з'єднані з гальванічною батареєю, заряджаються і їх потім можна протягом короткого часу використовувати як постійне джерело струму. Це явище пізніше вивчалося багатьма іншими вченими.
У 1854 році німецький військовий лікар Вільгельм Зінстеден спостерігав наступний ефект: при пропущенні струму

Якщо такий елемент замикали потім накоротко, припинивши пропускання через нього струму від постійного джерела, то в ньому з'являвся постійний струм, який виявлявся до тих пір, поки вся двоокис свинцю не розчинялася в кислоті. Таким чином, Зінстеден впритул наблизився до створення акумулятора, проте він не зробив ніяких практичних висновків зі свого спостереження.
Тільки п'ять років по тому, в 1859 році, французький інженер Гастон Планте (Gaston Plante) випадково зробив те ж саме відкриття і побудував перший в історії свинцевий акумулятор. Цим було покладено початок акумуляторної техніки.
Акумулятор Планте складався з двох однакових свинцевих пластин, навитих на дерев'яний циліндр. друг від

Чим пояснюються процеси, що протікають в акумуляторі? Як і в гальванічному елементі, електричний струм тут - наслідок хімічної реакції, яка може протікати багато разів в обидві сторони. Уявімо собі, що ми починаємо зарядку розрядився акумулятор, приєднавши його до джерела постійного струму. Зазвичай ще не заряджена маса позитивної свинцевою платівки містить на собі залишки попереднього циклу - окис свинцю PbO і сірчанокислий свинець PbSO4, а негативна - тільки окис свинцю PbO.
Під дією електричного струму електроліт - подкисленная вода - починає розкладатися: на позитивних пластинах виділяється кисень, який тут же окисляє окис свинцю і сірчанокислий свинець до перекису PbO2 (причому кислотний залишок SO4 йде в розчин), а на негативній пластині виділяється водень. Останній з'єднується з киснем окису, утворюючи металевий свинець і воду. Потім газ починає накопичуватися в порах свинцевою пластини.
Якщо заряджений акумулятор включити в ланцюг, то струм, що проходив через акумулятор під час зарядки,

Сірчана кислота з рідини переходить на позитивний електрод і знову утворює сірчанокислий свинець, тоді як водень і свинець на негативній пластині окислюються, перший - в воду, другий - в окис свинцю. В дещо спрощеному вигляді (без урахування паралельних процесів) хімічна реакція розрядки має вигляд: PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O.
При зарядці явища йдуть в протилежну сторону. Ця реакція, що супроводжується виділенням електричного струму, триває до тих пір, поки кількість окису свинцю на обох платівках врівноважується. Та ж реакція йде в розімкнутому акумуляторі, але набагато повільніше. При заряджанні (внаслідок виділення кислотного залишку в розчин) питома вага рідини в акумуляторі збільшується, а при розрядженні - зменшується (оскільки
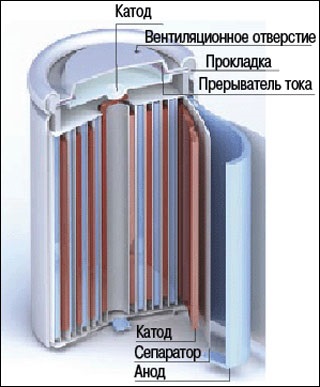
Істотним недоліком акумулятора Планте була його невелика ємність - він занадто швидко розряджався. Незабаром Планте зауважив, що ємність можна збільшити спеціальною підготовкою поверхні свинцевих пластин, які повинні бути по можливості більш пористими. Щоб домогтися цього, Планте розряджав заряджений акумулятор, а потім знову пропускав через нього струм, але в протилежному напрямку. Цей процес формування пластин повторювався багаторазово протягом приблизно 500 годин і мав на меті збільшити на обох платівках шар окису свинцю.
До тих пір, поки не була винайдена динамо-машина, акумулятори представляли для електротехніків мало інтересу, але коли з'явилася можливість легко і швидко заряджати їх за допомогою генератора, акумулятори отримали широке розповсюдження. У 1882 році Камілл Фор значно вдосконалив техніку виготовлення акумуляторних пластин.

Щоб маса оксидів, що утворюється на пластинах, які не відвалювалася, їх покривали тканиною. Акумулятор Фора не тільки заряджався швидше акумулятора Планте, але мав також значно більшу ємність і міг давати дуже сильний струм. Він складався з паралельних свинцевих пластин, поміщених близько одна від одної і з'єднаних через одну, так що кожен електрод одного знака містився між двома електродами

Винахід Фора відразу звернуло на себе увагу електротехніків. Німецький банкір Фолькмар, який взявся за виробництво акумуляторів Фора, незабаром ще більш удосконалив їх. У колишніх акумуляторах шар окислів, як уже говорилося, погано тримався на решітці і при трясці легко відвалювався.
Це було серйозним недоліком конструкції, оскільки заважало застосовувати акумулятори на транспорті. Щоб виправити становище, Фолькмар запропонував робити свинцеві платівки не суцільними, а у вигляді решіток, отвори яких набивали губчастим свинцем. На таких решітках активна маса вже не просто налипала до свинцю, а міцно трималася в осередках.
На початку XX століття удосконаленням акумулятора зайнявся Едісон, який хотів зробити його більш

Як завжди, Едісон приступив до справи з великим розмахом: він створив спеціальну лабораторію з великим штатом фахівців-хіміків і доручив їм дослідження по всіх перерахованих напрямках. По суті, мова йшла про створення абсолютно нового типу акумулятора, в якому електролітом служила луг, а негативним електродом - подрібнене залізо з деякими домішками. Довгий час не вдавалося вибрати матеріал для позитивного електрода. Оскільки хімічні процеси в лужному акумуляторі були дуже складні і не до кінця зрозумілі, доводилося йти буквально навпомацки. В експериментальних моделях позитивний електрод робили з вугілля, пори якого заповнювали різними речовинами: випробували безліч металів і їх з'єднань, але всі вони давали недостатньо хороший результат.
Нарешті, зупинилися на нікелі, який виявився найбільш підходящим. Так Едісон прийшов до залізно-нікелевого акумулятора з електролітом у вигляді їдкого калі. Хімічна реакція, що протікає при розряді в

Було виготовлено кілька таких акумуляторів для всебічних випробувань, і тут дослідників спіткало розчарування - ємність акумуляторів виявилася дуже маленькою. Едісон звернув увагу, що чистота матеріалу має велике значення для збільшення ємності. Він замовив для проб високосортних канадський нікель, після чого ємність акумуляторів відразу зросла в три рази. У Вест-Орендж була побудована невелика фабрика для рафінування (очищення) заліза і нікелю. Ємність нового акумулятора виявилася в 2, 5 рази більше, ніж у старого свинцевого. Едісон стверджував, що це найбільший прогрес в акумуляторної техніці з часів її зародження.
Доведення була доручена відразу декількох груп: одна працювала над удосконаленням зварювання акумуляторних судин, інша - над рафинированием заліза, третя займалася нікелем і присадками до нього. До 1905 року було проведено понад 10 тисяч додаткових дослідів, а в 1910 році значно вдосконалений акумулятор знову надійшов у виробництво. У перший же рік було випущено продукції на 1 мільйон доларів, і вся вона знайшла хороший збут. Незабаром новий портативний акумулятор набув широкого поширення в транспорті, на електростанціях, в невеликих судах і на підводних човнах.