Механізми розвитку (патофізіологія) інфаркту міокарда
Інфаркт міокарда (ІМ) є загибель ділянки міокарда в результаті тривалої важкої ішемії. До теперішнього часу це найбільш значуща форма ІХС. Близько 1,5 млн осіб в США щорічно переносять ІМ.
а) Захворюваність і фактори ризику. ІМ може статися практично в будь-якому віці, однак частота його виникнення збільшується з роками, особливо в разі генетичної схильності до атеросклерозу. Близько 10% ІМ виникає у осіб молодше 40 років і 45% - у осіб молодше 65 років. Частота ІМ у осіб з білим і темним кольором шкіри однакова. Протягом усього життя ризик ІМ у чоловіків значно вище, ніж у жінок. Жінки захищені від ІМ та інших хвороб серця в репродуктивному періоді, за винятком випадків, коли є умови, що призводять до атерогенезу.
Однак зниження рівня естрогенів після менопаузи асоціюється зі швидким збільшенням захворюваності ІХС, і ІХС стає найбільш поширеною причиною смерті жінок похилого та старечого віку. Проте в даний час не вважають, що замісна гормональна терапія в постменопаузі захищає від атеросклерозу і ІХС в достатній мірі.
б) Патогенез. Розглянемо механізми розвитку і наслідки ішемії міокарда.
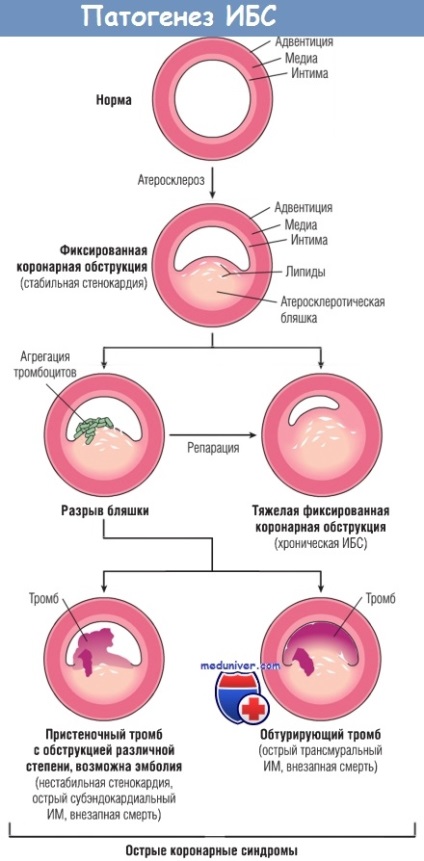
Оклюзія коронарних артерій. У типових випадках ІМ найбільш імовірна наступна послідовність подій:
1. Первинним процесом є раптова зміна атеросклеротичної бляшки - геморагія, ерозія, виразка, розрив або розтріскування.
2. Коли оголюються субендотеліальний колаген і некротичні вміст бляшки, тромбоцити на цій ділянці адгезіруют і активуються, вивільняючи вміст своїх гранул, потім відбувається агрегація з утворенням микротромбов.
3. Медіатори, що вивільняються тромбоцитами, стимулюють спазм судин.
4. Тканинний фактор активує процес коагуляції, додатково збільшуючи розмір тромбу.
5. Часто тромб, збільшуючись в розмірах, повністю закриває просвіт судини протягом декількох хвилин.
Запропонована послідовність процесів заснована на:
(1) даних аутопсії пацієнтів, які померли від гострого ІМ;
(2) даних ангіографії, що вказують на високу частоту тромботической оклюзії незабаром після ІМ;
(3) вираженому позитивному ефекті коронарної реваскуляризації (наприклад, за допомогою тромболізису, ангіопластики, застосування стентів або хірургічного втручання) після ІМ;
(4) виявленні при ангіографії залишкових змін атеросклеротичних бляшок після тромболізису.
Коронарна ангіографія. виконана протягом 4 год від початку ІМ, виявляє тромб у коронарній артерії в 90% випадків, а через 12-24 годину від початку ІМ - тільки в 60% випадків, що свідчить про певної міри дозволу оклюзії завдяки фибринолизу і / або ослаблення спазму.
У 10% випадків трансмуральний ІМ відбувається за відсутності типової патології коронарних судин. У таких ситуаціях відповідальними за зниження коронарного кровотоку можуть бути інші механізми:
- спазм судин. Може бути викликаний різними причинами, наприклад зловживанням кокаїном, і може асоціюватися з агрегацією тромбоцитів;
- емболія. Емболи потрапляють в коронарні артерії з лівого передсердя при фібриляції передсердь, пристеночном тромбозі в лівих відділах серця, вегетації при інфекційному ендокардиті, наявності всередині серця протезного матеріалу або з правих відділів серця або периферичних вен - ішемія в відсутність коронарного атеросклерозу і тромбозу. Ймовірно, до ішемії призводять такі порушення під внутрістеночних коронарних судинах, як васкуліт, гематологічні захворювання (наприклад, серповидно-клітинна анемія, амілоїдоз) і розшарування стінки судини, а також зниження артеріального тиску (шок) або неправильна «захист» міокарда під час операції на серце.
ІХС - ішемічна хвороба серця; ІМ - інфаркт міокарда.
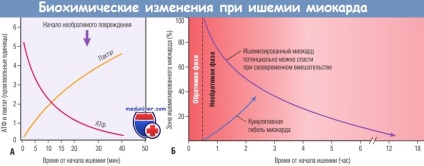
(А) Ранні зміни полягають у втраті аденозинтрифосфату (АТФ) і накопиченні лактату.
(Б) Протягом »30 хв після початку навіть важкої ішемії пошкодження міокарда потенційно можна зупинити. Потім відбувається прогресуюча втрата життєздатності, яка завершується через 6-12 год.
Сприятливий ефект реперфузії максимальний, якщо її вдається виконати досить рано, і ефект знижується, якщо реперфузію виконують пізніше.
в) Реакція міокарда. Обструкція коронарної артерії знижує доставку крові в певну область міокарда, викликаючи ішемію, дисфункцію міокарда і можливу загибель кардіоміоцитів. Анатомічна область, до якої підведений кров'ю з цієї артерії, є зоною ризику. Результат залежить головним чином від тяжкості ураження і тривалості обмеження кровотоку.
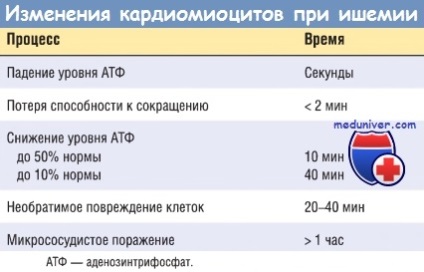
Рано біохімічним наслідком ішемії міокарда є припинення аеробного метаболізму протягом декількох секунд після початку ішемії, що приводить до недостатнього утворення високоенергетичних фосфатів (креатинфосфату і аденозинтрифосфату) і накопиченню потенційно шкідливих метаболітів (зокрема, лактату). В результаті виняткової залежності функції міокарда від кисню важка ішемія індукує втрату скоротливості вже протягом 1 хв. Припинення функції здатне викликати гостру серцеву недостатність задовго до загибелі клітин міокарда.
Ультраструктурні зміни (включаючи розслаблення міофібрил. Виснаження запасів глікогену, набухання клітин і мітохондрій) також відбуваються протягом декількох хвилин від початку ішемії. Проте ці ранні зміни потенційно оборотні. Як показали експериментальні і клінічні дослідження, лише важка ішемія тривалістю 20-30 хв або більше призводить до необоротного пошкодження (некрозу) кардіоміоцитів. Ультраструктурні зміни при незворотному пошкодженні кардіоміоцитів (в першу чергу структурні дефекти сарколеми) спостерігаються лише після тривалої, важкої ішемії міокарда (це відбувається при зниженні кровопостачання до 10% норми або нижче).
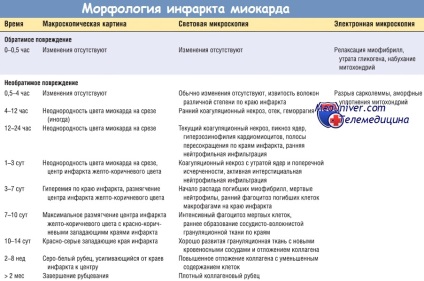
Ключовою ознакою ранньої фази некрозу кардіоміоцитів в служить порушення цілісності сарколеми, що дозволяє внутрішньоклітинним макромолекулам вивільнятися з клітин в інтерстиціальну тканину серця і в кінцевому підсумку - в мікросудинної русло і лімфатичні судини області інфаркту. Тести, що дозволяють визначити рівень білків міокарда в крові, мають велике значення для діагностики та лікування ІМ (див. Далі). При збільшенні тривалості важкої ішемії порушується мікроциркуляція. Прогресування цих процесів у часі представлено в таблиці нижче.
У більшості випадків гострого ІМ постійного погіршення серця відбувається після певного періоду часу, як правило через 2-4 год. Це дає можливість провести раннє втручання на коронарних судинах для відновлення перфузії і врятувати якомога більше міокарда, що знаходиться в зоні підвищеного ризику.
Прогресування ішемічного некрозу в міокарді в загальному вигляді представлено на малюнку нижче. Ішемія найбільш виражена в зоні субендокарда, тобто необоротне поразка ішемізованих кардіоміоцитів відбувається в першу чергу в субендокардіальному зоні. При більш широкою ішемії «фронт» загибелі клітин поширюється, захоплюючи все більшу площу. На локалізацію, розміри і морфологічні ознаки гострого ІМ впливають такі чинники:
- локалізація, тяжкість і швидкість розвитку коронарної обструкції внаслідок атеросклерозу і тромбозу;
- розмір судинного ложа, перфузіруемих судинами, що зазнали обструкції;
- тривалість оклюзії;
- метаболічні потреби міокарда і його потреба в кисні в зоні підвищеного ризику;
- ступінь розвитку колатеральних кровоносних судин;
- наявність, локалізація і тяжкість коронарного спазму;
- інші чинники, наприклад ЧСС, серцевий ритм і ступінь оксигенації крові.
Необоротне ушкодження міокарда зазвичай завершується протягом 6 годину з початку важкої ішемії міокарда. У тих випадках, коли система колатеральних коронарних артерій розвинена в достатній мірі під впливом хронічної ішемії, цей термін подовжується і може перевищити 12 год.
Визначення області міокарда. яку перфузируют основні коронарні артерії, допомагає встановити кореляцію між рівнем судинної обструкції і зоною ІМ. Передня спадна гілка лівої коронарної артерії кровоснабжает більшу частину верхівки серця (дистальний відділ шлуночків), передню стінку лівого шлуночка і передні дві третини міжшлуночкової перегородки. Коронарну артерію (праву коронарну або огибающую), перфузируются задню третину міжшлуночкової перегородки, називають домінантною (незважаючи на те що передня низхідна і огинає артерії разом перфузируют більшу частину міокарда лівого шлуночка).
При домінантною правої коронарної артерії. що зустрічається у 80% індивідів, огинає артерія перфузируются тільки латеральну стінку лівого шлуночка, а права коронарна артерія постачає всю вільну стінку правого шлуночка, заднебазальних стінку лівого шлуночка і задню третину міжшлуночкової перегородки. Таким чином, пошкодження лівого шлуночка може викликати оклюзія як правою, так і лівою коронарної артерії. Права і ліва коронарні артерії функціонують як кінцеві артерії, хоча анатомічно в більшій частині серця присутні численні межкоронарного анастомози (судинні сполуки, що забезпечують колатеральний кровообіг).
У здоровому серці через колатералі проходить невелика кількість крові, однак, коли артерія різко звужена, кров із системи з високим тиском в систему з низьким тиском проходить через колатералі і викликає їх розширення. Таким чином, розширення і розвиток колатералей під впливом ішемії можуть відігравати важливу роль в кровопостачанні областей міокарда, які без цього можуть бути позбавлені необхідної перфузії.
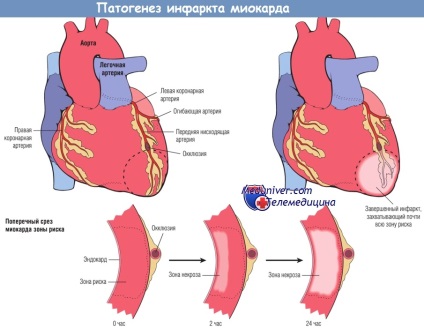
Некроз починається в невеликій області міокарда під ендокардит, в центрі ишемизированной зони.
Область, перфузіруемих обтуріровать артерією, є зоною ризику ураження міокарда (область всередині пунктирною лінії).
Зверніть увагу, що дуже вузька область міокарда, що знаходиться безпосередньо під ендокардит, що не піддається некрозу, тому що в неї надходить кисень з крові шляхом дифузії безпосередньо з порожнини шлуночка.