Механізми старіння клітини і її етапи
У. Шекспір. можливо, краще за всіх охарактеризував процес старіння, тонко описавши сім вікових періодів. Все починається з моменту зачаття, потім відбувається поступове дозрівання організму, потім починається процес, що приводить до повної втрати функцій організму, і закінчується смертю.
Процес старіння клітини можна уявити як прогресуюче накопичення сублетальлними порушень протягом багатьох років, що обумовлює зниження здатності клітини відповідати на пошкодження або приводить до її смерті.
Старіння клітини - результат прогресуючого зниження її функції і життєздатності, викликаного генетичними аномаліями і накопиченням пошкоджень в клітці і молекулах в результаті зовнішніх впливів.
Дослідження експериментальних моделей старіння дозволили встановити, що старіння - регульований процес, контрольований обмеженою кількістю генів і генетичними аномаліями, що лежать в основі синдромів передчасного старіння. Ці дані дозволили припустити зв'язок старіння з певними змінами.
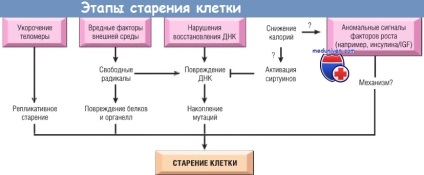
Зміни, що сприяють старінню клітини.
- знижена реплікація клітини. Концепція, що більшість нормальних клітин мають обмежену можливість реплікації, була розроблена при вивченні простий експериментальної моделі старіння. Нормальні фібробласти людини при перенесенні в культуру тканини мають обмежений потенціал поділу.
Після фіксованої кількості поділів все соматичні клітини залишаються в термінальному не ділиться статус, званому фізіологічним старінням. Клітини дітей проходять більше кіл реплікації, ніж клітини літніх людей. Клітини хворих синдромом Вернера (на рідкісну хворобу, яка характеризується ознаками передчасного старіння) мають порушення реплікації ДНК і значно обмежену здатність до поділу.
До сих пір невідомо, чому старіння організму пов'язане з прогресуючим старінням клітин. Можливо, це відбувається через наявність незавершеної реплікації кінців хромосом (вкорочення теломери) при діленні клітини, яка в підсумку призводить до зупинки клітинного циклу.
Теломери - короткі повторювані послідовності ДНК (TTAGGG), що знаходяться на лінійних кінцях хромосом, необхідні для забезпечення завершеною реплікації кінців хромосом і для захисту їх від розплавлення і деградації. Під час реплікації соматичних клітин невелика частина теломери НЕ подвоюється, і теломера стає набагато коротше. У зв'язку з цим кінці хромосом сприймаються як зламана ДНК, що активує відповідь на пошкодження ДНК і сигнал до зупинки клітинного циклу.
У нормі довжина теломери підтримується нуклеотидним додаванням ферменту теломерази. Теломераза - спеціалізований РНК-білковий комплекс, який використовує власну РНК для додавання нуклеотидів до кінців хромосом. Активність теломерази пригнічують регуляторні білки, які контролюють довжину теломери і відрізають непотрібні подовження. Теломеразная активність висока в зародкових клітинах і присутній в незначній мірі в стовбурових клітинах, але в соматичних клітинах вона практично відсутня.
Оскільки при розподілі соматичних клітин їх теломери стають коротшими, клітини виходять з клітинного циклу, що призводить до неможливості отримання нових клітин для заміни пошкоджених. Таким чином, накопичення старих клітин і виснаження пулу стовбурових клітин в результаті старіння клітин сприяють старінню всього організму. З іншого боку, відомо, що в пухлинних клітинах теломерази активуються і довжина теломер стає постійною. Це дозволило припустити, що стабільність довжини - важливе, можливо основне, умова розвитку пухлини.
Однак зв'язок теломеразной активності і довжини теломер зі старінням і пухлинним ростом ще до кінця не вивчена.
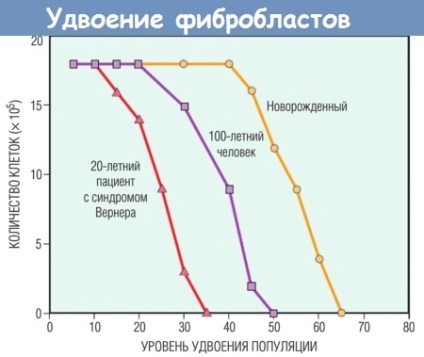
Реплікативного старіння також може бути індуковано підвищеною експресією інгібітора клітинного циклу pl6 / INK4a і пошкодженням ДНК (див. Далі). Яким чином ці фактори беруть участь в нормальному процесі старіння - невідомо;
- накопичення метаболічного і генетичного ушкодження. Тривалість життя клітини залежить від балансу між пошкодженням в результаті метаболічних процесів в клітині і захисними молекулярними відповідями, які можуть усунути пошкодження. Активні форми кисню - це група токсичних продуктів нормального метаболізму.
Ці побічні продукти окисного фосфорилювання викликають ковалентну модифікацію білків, ліпідів і нуклеїнових кислот (див. Раніше). Посилене окисне пошкодження може бути результатом повторюваного впливу зовнішніх факторів (наприклад, іонізуючої радіації), а також мітохондріальної дисфункції або зниження при старінні антиоксидантного захисту, що забезпечується, наприклад, вітаміном Е і глутатіонпероксидази.
Розмір окисного пошкодження. посилюється з віком, може бути важливою причиною старіння. Цей факт підтверджується наступними спостереженнями:
(1) тривалість життя різних форм організмів назад корелює з рівнями О2, що виробляється мітохондріями;
(2) гіперекспресія антиоксидантних ферментів СОД і каталази продовжує час життя трансгенетіческіх форм мушки Drosophila. Вільні радикали можуть негативно впливати на ДНК, що призводить до поломок і нестабільності геному, таким чином впливаючи на функції клітин.
Захисні відповіді врівноважують прогресуюче пошкодження клітин. найважливіший з них - репарація пошкодженої ДНК. Хоча пошкодження ДНК відновлюється переважно ендогенними, ДНК-репаруючу ферментами, деякі з них з віком накопичуються в клітинах. Доведено важливість репарації ДНК в процесі старіння.
У пацієнтів з синдромом Вернера (одним із синдромів передчасного старіння) дефектний ген виробляє ДНК-ХЕЛІКАЗИ - білок, залучений в реплікацію і репарацію ДНК і інші процеси при розкручуванні ДНК. Дефект цього ферменту викликає швидке накопичення пошкоджень хромосом, що може симулювати пошкодження, в нормі що відбуваються при старінні. Генетична нестабільність соматичних клітин також характерна для інших розладів, при яких у пацієнтів з'являються ознаки старіння, наприклад для атаксії-телеангіектазії, при якій мутантні гени кодують білки, залучені в репарацію розривів дволанцюжкових ДНК.
Таким чином, по співвідношенню між кумулятивним метаболічним пошкодженням і відповіддю на нього можна визначити швидкість старіння людини. При такому сценарії старіння може запізнюватися завдяки зниженню накопичення ушкоджень або посилення відповіді на них.
З віком кумулюються пошкодження не тільки ДНК. але і клітинних органел. Частково це може бути результатом зниження функції протеасом, елімінувальних аномальні і небажані внутрішньоклітинні білки.
Дослідження на моделях організмів (від дріжджів до ссавців) виявили, що найбільш ефективний спосіб продовження життя - зниження калорій. Механізм цього до цих пір невідомий, але вплив зниження калорій на тривалість життя, ймовірно, опосередковується сімейством білків сіртуїнів. Сиртуїн мають активність деацетілази гістонів, і вважається, що вони викликають експресію декількох генів, продукти яких збільшують тривалість життя.
Ці продукти представлені білками. які підвищують метаболічну активність, знижують апоптоз, стимулюють згортання білків і інгібують несприятливі ефекти АФК. Сиртуїн також підсилюють чутливість до інсуліну і метаболізм глюкози і можуть бути мішенями при лікуванні цукрового діабету. Любителі вина будуть раді почути, що компоненти червоного вина активують сиртуїн, тим самим продовжуючи життя людини.
Інші дослідники виявили, що такі фактори росту. як інсуліноподібний фактор росту, і внутрішньоклітинні сигнальні шляхи, індуковані сиртуїн, також впливають на тривалість життя. Фактори транскрипції, активовані сигналами інсулінових рецепторів, можуть індукувати гени, які вкорочують життя, тому мутації інсулінових рецепторів її продовжують. В даний час всі ці питання - область активних досліджень.
Різні форми клітинних змін і адаптаційних реакцій. охоплюють широкий спектр - від адаптацій розміру клітин, росту і функцій до оборотних і необоротних пошкоджень клітин і апоптозу, патологічних змін в органелах клітини і внутрішньоклітинних накопичень, включаючи пігментації. На ці зміни посилаються в наступних розділах при клінічному описі захворювань, тому що всі пошкодження органів відбуваються в результаті змін структури і функцій клітини.
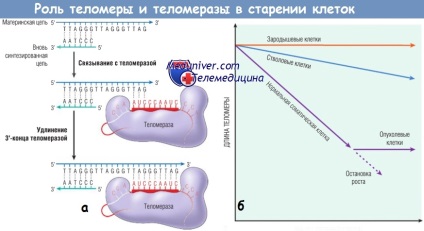
(А) теломерази направляють РНК-залежний синтез ДНК, при якому нуклеотиди додаються до одного ланцюга в кінці хромосоми. Знову синтезована ланцюг доповнюється полимеразой ДНК.
(Б) Гіпотеза теломери / теломерази і проліферативна здатність клітин.
Довжина теломери протиставляється числу поділок клітини. І зародкові, і стовбурові клітини містять теломерази, але тільки зародкові клітини мають значимі рівні цього ферменту для повної стабілізації довжини теломери.
У нормальних соматичних клітинах теломерази не виявляють свою активність, теломери коротшають з кожним наступним поділом клітини, поки клітина не вступає в фазу зупинки клітинного циклу або не старіє.
Активація теломераз в пухлинних клітинах призводить до вкорочення теломер і обмежує здатність до поділу нормальних соматичних клітин.