Різні речовини мають різну будову. З усіх відомих на сьогоднішній день речовин тільки інертні гази існують у вигляді вільних (ізольованих) атомів, що обумовлено високою стійкістю їх електронних структур. Всі інші речовини (а їх в даний час відомо більше 10 млн.) Складаються з пов'язаних атомів.
Примітка: курсивом виділені ті частини тексту, які можна не вчити і не розбирати.
Освіта молекул з атомів призводить до виграшу енергії, так як в звичайних умовах молекулярне стан стійкіше, ніж атомне.
У атома на зовнішньому енергетичному рівні може міститися від одного до восьми електронів. Якщо число електронів на зовнішньому рівні атома максимальне, яке він може вмістити, то такий рівень називається завершеним. Завершення рівні ха-рактерізует великою міцністю. Такі зовнішні рівні атомів благородних газів: у гелію на зовнішньому рівні два електрона (s 2), у інших - по вісім електронів (ns 2 np 6). Зовнішні рівні атомів інших елементів незавершені і в процесі хімічної взаємодії вони завершуються.
Хімічна зв'язок утворюється за рахунок валентних електронів, але здійснюється вона по-різному. Розрізняють три основних типи хімічних зв'язків: ковалентний, іонну і металеву.
Механізм виникнення ковалентного зв'язку розглянемо на прикладі утворення молекули водню:
Н + Н = Н2; Q = 436 кДж
Ядро вільного атома водню оточене сферически симетричним електронним хмарою, утвореним 1 s-електроном. При зближенні атомів до певної відстані відбувається часткове перекривання їх електронних хмар (орбіталей)
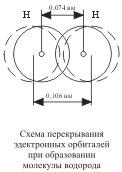
В результаті між центрами обох ядер виникає молекулярне двухелектронних хмара, що володіє максимальною електронної щільністю в просторі між ядрами; збільшення ж щільності негативного заряду сприяє сильному зростанню сил тяжіння між ядрами і молекулярною хмарою.
Отже, ковалентний зв'язок утворюється в результаті перекривання електронних хмар атомів, що супроводжується виділенням енергії. Якщо у сблизившихся до торкання атомів водню відстань між ядрами становить 0,106 нм, то після перекривання електронних хмар (утворення молекули Н2) ця відстань складає 0,074 нм. Найбільше перекривання електронних хмар здійснюється уздовж лінії, що з'єднує ядра двох атомів (це відбувається при утворенні # 963;-зв'язку). Хімічна зв'язок тим міцніше, чим більше перекривання електронних орбіталей. В результаті виникнення хімічного зв'язку між двома атомами водню кожен з них досягає електронної конфігурації атома благородного газу гелію.
Зображати хімічні зв'язки прийнято по-різному:
1) за допомогою електронів у вигляді точок, поставлених у хімічного знака елемента. Тоді освіту молекули водню можна показати схемою
H # 8729; + H # 8729; → H: H
2) часто, особливо в органічній хімії, ковалентний зв'язок зображують рискою (штрихом) (наприклад, Н-Н), яка символізує загальну пару електронів.
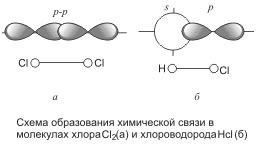
Ковалентний зв'язок в молекулі хлору також здійснюється з по-міццю двох загальних електронів, або електронної пари:
Неподіленої пари електронів, в атомі їх 3
← неподіленої пари електронів,
↑ ↑ в молекулі їх 6.
неспарених електронів загальна або поділена пара електронів
Як видно, кожен атом хлору має три неподіленого пари і один неспарених електронів. Утворення хімічного зв'язку відбувається за рахунок неспарених електронів кожного атома. Неспарені електрони зв'язуються в загальну пару електронів, яка також називається поділеної парою.
Якщо між атомами виникла одна ковалентний зв'язок (одна загальна електронна пара), то вона називається одинарної; якщо більше, то кратної подвійний (дві загальні електронні пари), потрійний (три загальні електронні пари).
Одинарна зв'язок зображується однією рискою (штрихом), подвійна - двома, потрійна - трьома. Риска між двома атомами показує, що у них пара електронів узагальнена, в результаті чого і утворилася хімічний зв'язок. За допомогою таких рисок зображують структурні формули молекул.
Отже, в молекулі хлору кожен його атом має завершений зовнішній рівень з восьми електронів (s 2 p 6), причому два з них (електронна пара) в однаковій мірі належать обом атомам. Перекриття електронних орбіталей при утворенні молекули показано на рис:
У молекулі азоту N2 атоми мають три загальні електронні пари:
Очевидно, молекула азоту міцніше молекули водню або хлору, чим і обумовлена значна інертність азоту в хімічних реакціях.
Хімічна зв'язок, здійснювана електронними парами, називається ковалентним.
Механізми утворення ковалентного зв'язку.
Ковалентний зв'язок утворюється не тільки за рахунок перекривання одноелектронних хмар, - це обмінний механізм утворення ковалентного зв'язку.
При обмінному механізмі атоми надають в загальне користування однакову кількість електронів.
Можливий і інший механізм її утворення - донорно-акцепторні. В цьому випадку хімічний зв'язок виникає за рахунок неподіленої електронної пари одного атома і вільної орбіталі іншого атома.
Розглянемо як приклад механізм утворення іона амонію NH4 +
При взаємодії аміаку з НСl відбувається хімічна реакція:
NH3 + HCl = NH4 Cl або в скороченому іонному вигляді: NH3 + Н + = NH4 +
При цьому в молекулі аміаку атом азоту має неподеленную пару електронів (двухелектронних хмара):
У іона водню вільна (не заповнена) 1s-орбіталь, що можна позначити як # 9633; H +
При утворенні іона амонію відбувається перекривання орбіталі атома азоту, зайнятої неподіленої електронної парою, з порожньою орбиталью іона водню (двухелектронних хмара азоту стає загальним для атомів азоту і водню, тобто воно перетворюється в молекулярне електронне хмара). А значить, виникає четверта ковалентний зв'язок. Процес утворення іона амонію можна представити схемою:
Заряд іона водню стає загальним (він делокалізованних, тобто розосереджений між усіма атомами), а двухелектронних хмара (неподіленого електронних пари), що належить азоту, стає загальним з воднем. У схемах зображення осередки # 9633; часто опускається.
Атом, що надає неподеленную електронну пару, називається донором, а атом, що приймає її (тобто надає вільну орбіталь), називається акцептором.
Механізм утворення ковалентного зв'язку за рахунок двухелектронних хмари одного атома (донора) і вільної орбіталі іншого атома (акцептора) називається донорно-акцепторні. Утворена таким шляхом ковалентний зв'язок називається донорно-акцепторної зв'язком.
Однак це не особливий вид зв'язку, а лише інший механізм (спосіб) утворення ковалентного зв'язку. За властивостями четверта N-Н-зв'язок в іоні амонію нічим не відрізняється від інших трьох.