Хімія і хімічна технологія
Плавлення настає тоді, коли ефективне поперечний переріз. припадає на одну ланцюг, стає більше, -ніж це допускається силами міжмолекулярної тяжіння. скріпними кристал. [C.230]
При відриві молекул з великим запасом енергії з поверхні загальна енергія випаровується рідини перерозподіляється йдуть в навколишнє газовий простір швидкі молекули. долаючи сили міжмолекулярної тяжіння. частина енергії витрачають на здійснення роботи відриву, в результаті чого енергія залишаються ще молекул в рідині зменшується й рідина поступово охолоджується. Для того щоб процес випаровування протікав при Г = 1
Чи мають відношення сили міжмолекулярної тяжіння до інших властивостей рідин, таким, як в'язкість або температура затвердіння Пошукайте в довідниках і розташуйте пентан, октан і декан в порядку збільшення в'язкості. Учитель перевірить ваші дані. [C.184]
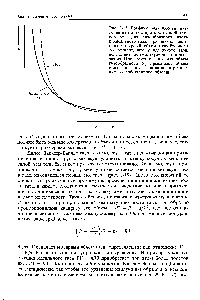
Мал. 3-18. меньшеніе тиску реального газу в результаті міжмолекулярної тяжіння. [C.154]
Реальні гази мають властивості. не стільки відрізняються від ідеальних, тому що їх молекули насправді не є точковими масами. позбавленими обсягу, і тому що ці молекули притягуються один до одного. Міжмолекулярним тяжінням неможливо нехтувати в умовах, коли молекули рухаються повільніше, як це відбувається при знижених температурах наявність власного обсягу у молекул починає проявлятися при сильному стисненні газу. Отже, властивості газів краще наближаються до ідеальних при високих температурах і низьких тисках. [C.157]
Підвищення температури перешкоджає силам межатомного (міжмолекулярної) тяжіння, що сприяє упорядкуванню системи. і підсилює хаотичний рух. т. е. дезагрегацию частинок. Тому при дуже низьких температурах переважає перша тенденція, при високих - друга. Дійсно, якщо процеси асоціації молекул і синтезу речовин для свого здійснення, як правило, вимагають низькотемпературного режиму, то реакції розкладання зазвичай протікають при високих температурах. [C.48]
Для виробництва ХВ можуть використовуватися тільки полімери, що складаються з гнучких макромолекул лінійної або слабо розгалуженої форми, з високою молекулярною когезией, що забезпечує міцне зчеплення макромолекул під впливом сил міжмолекулярної тяжіння. молекулярною масою в межах 10-10 -10 і досить вузьким молекулярно-масовим розподілом. [C.410]
Залежно від величин міжмолекулярної тяжіння в неідеальних системах коефіцієнти активності можуть бути больще і менше одиниці. Чисельне значення коефіцієнта активності є функцією всіх інших компонентів в розчині і їх концентрації. Наприклад, для компонента А в подвійній суміші Уа = Ь якщо х =. так як чисті рідини розглядаються як ідеальні розчини. У міру того як концентрація падає, уд збільшується і досягає максимуму при х = 0. Така ж залежність спостерігається і для інших компонентів. [C.19]
Для лінійних полімерів досить характерна представлена на рис. 214 залежність міцності на розрив від ступеня полімеризації Р. При малих Р міцність мала, але швидко зростає при збільшенні ступеня полімеризації від 100 до 300 і, починаючи з Р, рівного 400, залишається майже незмінною. Це пояснюється тим, що при малій величині молекул полімеру для розриву його доводиться долати тільки порівняно слабкі сили міжмолекулярної тяжіння (молекули ковзають одна вздовж іншої, а при біль, шей довжині ланцюгів. Внаслідок розглянутих вище особливостей [c.588]
Сили міжмолекулярної тяжіння за своїми абсолютними значеннями є досить суттєвими і досягають максимуму на відстанях між частинками значно менша в порівнянні з їх розмірами. Зі збільшенням розмірів частинок на відповідних їм відстанях сили міжмолекулярної тяжіння дещо зменшуються. [C.40]
Крім того, є й інші причини. зумовлюють виникнення сил зчеплення між частинками і визначають значення додаткової складової Те в умовах втрати стійкості стаціонарного шару (1.3). Це, наприклад, вологість, створює капілярні містки навколо місць зіткнення частинок. Потім статичну електрику. виникає при терті насипати частинок. Для дуже дрібних частинок з діаметром 40-60 мкм починають відігравати суттєву роль вандерваальсови сили міжмолекулярної тяжіння поверхневих шарів зерен. [C.26]
Описана структура полімеру поводиться подібно коагуляционной структурі. Подібність в поведінці цих структур полягає в тому, що для них характерні хімічні зв'язки всередині частинок і на порядок менше межчастичного взаємодії. Зі збільшенням полярності макромолекул зменшується їх гнучкість, а для міжмолекулярних взаємодій стають характерними всі три типи сил Ван-дер-Ваальса. Наявність таких функціональних груп. як 0Н, -СООН, -ИНг, обумовлює виникнення більш міцних водневих зв'язків. З ростом міжмолекулярної тяжіння полімер перетворюється в більш тверде, менш еластичне і навіть крихке речовина. втрачає плавкість і розчинність. Полімери з хімічними зв'язками між макромолекулам (просторові) нерозчинні і неплавки при нагріванні. За властивостями вони відповідають конденсаційним структурам. [C.391]
Іншими словами, в ізотропних термопластах при крихкому ослабленні матеріалу лише незначна частина (менше 1% всіх основних зв'язків) знаходиться в повністю напруженому стані. При таких умовах початок поширення нестабільної тріщини визначається величиною міжмолекулярної тяжіння. Повертаючись до даних Вінсента, слід сказати, що не число основних зв'язків на одиницю площі і притаманна їм міцність, а величина міжмолекулярних сил визначає макроскопічну міцність. Високі значення міцності обумовлені щільною упаковкою. [C.83]
Якщо два атома відрізняються по притаманною їм здатності притягувати електрони. т. е. по електронегативності, то електронна пара. за допомогою якої між ними створюється хімічний зв'язок. зміщується в бік атома з більшою електронегативність і на ньому виникає негативний заряд. а на іншому атомі-позитивний заряд. Такі зв'язку і молекули, в яких вони є, називаються полярними. Полярні молекули не тільки притягуються лругой до одного, але і можуть притягувати до себе позитивні або негативні іони. Температури кипіння і плавлення речовин з полярними молекулами вище, ніж можна було очікувати. судячи тільки по величині вандерваальсова сил тяжіння, оскільки полярність молекул зумовлює появу додаткових сил міжмолекулярної тяжіння. [C.52]
Теплота випаровування. точніше - загальна теплота випаровування рідини. складається з двох складових 1) енергії, що витрачається на подолання сил міжмолекулярної тяжіння в рідині (включаючи і асоціацію), званої внутрішньої теплотою мспа-ренію, і 2) енергії, що витрачається на подолання зовнішнього тиску при виділенні пара. званої зовнішньої теплотою (пли роботою) випаровування і рівній pAv. Зовнішня теплота завжди буває значно менше внутрішньої. Надалі ми будемо розглядати тільки загальну теплоту випаровування, називаючи її для стислості теплотою випаровування. [C.173]