Міжмолекулярної взаємодії має електричну природу і складається з сил тяжіння (орієнтаційних. Індукційних і дисперсійних) і сил відштовхування.
орієнтаційні сили
Два електричні диполі ab і cd при зазначеному взаємне розташування притягуються, т. К. Різнойменні заряди в точках b і з взаємодіють сильніше, ніж однойменні заряди в точках а і з (а також в b і d).
Орієнтаційні сили діють між полярними молекулами, тобто володіють дипольними електричними моментами. Сила тяжіння між двома полярними молекулами максимальна в тому випадку, коли їх дипольні моменти розташовуються уздовж однієї лінії (див. Малюнок). Ця сила виникає завдяки тому, що відстані між різнойменними зарядами трохи менше, ніж між однойменними. В результаті тяжіння диполів перевершує їх відштовхування. Взаємодія диполів залежить від їх взаємної орієнтації, і тому сили дипольної взаємодії називаються орієнтаційними. Хаотичний тепловий рух безперервно міняє орієнтацію полярних молекул, але, як показує розрахунок, середнє по всіляких орієнтаціям значення сили має певну величину, що не рівну нулю. Потенційна енергія орієнтаційного міжмолекулярної взаємодії:
де p1 і p2 - дипольні моменти взаємодіючих молекул.
Відповідно сила взаємодії: Fop
Сила Fор зменшується з відстанню значно швидше, ніж кулоновская сила взаємодії заряджених тіл (Fкул
індукційні сили
Індукційні (або поляризаційні) сили діють між полярною і неполярной молекулами. Полярна молекула створює електричне поле. яке поляризує молекулу з електричними зарядами, рівномірно розподіленими за об'ємом. Позитивні заряди зміщуються у напрямку електричного поля, а негативні - проти. В результаті у неполярной молекули індукується дипольний момент.
Енергія міжмолекулярної взаємодії в цьому випадку пропорційна дипольному моменту p1 полярної молекули і поляризуемости a2, що характеризує здатність іншої молекули поляризуватися:
Ця енергія називається індукційною. так як вона з'являється завдяки поляризації молекул, викликаної електростатичного індукції. Індукційні сили (Fінд
r -7) діють також і між полярними молекулами.
дисперсійні сили
Між неполярними молекулами діє дисперсійне міжмолекулярної взаємодії. Природа цієї взаємодії була з'ясована повністю лише після створення квантової механіки. В атомах і молекулах електрони складним чином рухаються навколо ядер. В середньому за часом дипольні моменти неполярних молекул виявляються рівними нулю. Але в кожен момент електрони займають якесь положення. Тому миттєве значення дипольного моменту (наприклад, у атома водню) відмінне від нуля. Миттєвий диполь створює електричне поле, поляризующее сусідні молекули. В результаті виникає взаємодія миттєвих диполів. Енергія взаємодії між неполярними молекулами є середній результат взаємодії всіляких миттєвих диполів з дипольними моментами, які вони наводять в сусідніх молекулах завдяки індукції. Потенційна енергія дисперсійного міжмолекулярної взаємодії:
a1a2 / r 6 а Fдісп
r -7 (тут a1 і a2 - поляризуемости взаємодіючих молекул).
Міжмолекулярної взаємодії даного типу називається дисперсійним тому, що дисперсія світла в речовині визначається тими ж властивостями молекул, що і це взаємодія. Дисперсійні сили діють між усіма атомами і молекулами, так як механізм їх появи не залежить від того, чи є у молекул (атомів) постійні дипольні моменти чи ні. Зазвичай ці сили перевершують по величині як орієнтаційні, так і індукційні. Тільки при взаємодії молекул з великими дипольними моментами, наприклад молекул води, Fор> Pдісп (в 3 рази для молекул води). При взаємодії ж таких полярних молекул, як CO. HI. HBr та інших, дисперсійні сили в десятки і сотні разів перевершують всі інші.
Дуже істотно, що всі три типи міжмолекулярної взаємодії однаковим чином зменшуються з відстанню:
U = Uop + Uінд + Uдісп
сили відштовхування
Сили відштовхування діють між молекулами на дуже малих відстанях, коли приходять в зіткнення заповнені електронні оболонки атомів, що входять до складу молекул. Існуючий в квантовій механіці принцип Паулі забороняє проникнення заповнених електронних оболонок один в одного. Виникаючі при цьому сили відштовхування залежать більшою мірою, ніж сили тяжіння, від індивідуальності молекул. До хорошого згодою з даними експериментів приводить допущення, що потенційна енергія сил відштовхування Uот зростає зі зменшенням відстані згідно із законом:
результуюче взаємодія
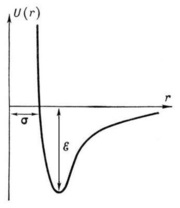
Залежність потенціалу U (r) міжмолекулярної взаємодії Леннарда-Джонса від відстані r між молекулами. Відстань r = σ - найменша можлива відстань між нерухомими молекулами, ε - глибина «потенційної ями» (енергія зв'язку молекул).
Якщо прийняти, що U (r) = 0 при r → ∞, і врахувати, що енергія тяжіння убуває із зменшенням відстані пропорційно r -6. а енергія відштовхування зростає як r -12. то крива U (r) буде мати вигляд, зображений на малюнку. Мінімуму потенційної енергії відповідає відстань, на якому сили взаємодії молекул дорівнюють нулю.
Розрахувати з достатньою точністю U (r) на основі квантової механіки при величезній різноманітності пар взаємодіючих молекул практично не можна. Не вдалося визначити поки і експериментально виміряти силу взаємодії на міжмолекулярних відстанях. Тому зазвичай підбирають таку формулу для U (r), щоб виконані з її допомогою розрахунки добре б узгоджувалися з експериментом. Найбільш часто користуються формулою:
U (r) = 4ε ((σ / r) 12 - (σ / r) 6)
так званим потенціалом Леннарда-Джонса. Вхідні у формулу величини σ і ε визначаються експериментально на основі залежності властивостей речовин (наприклад, коефіцієнти дифузії. Теплопровідності або в'язкості) від σ та ε.
Рівняння Ван-Дер-Ваальса
Ван дер Ваальса припустив, що на малих відстанях (r) між молекулами діють сили відштовхування, які зі збільшенням відстані змінюються силами тяжіння. На основі цих уявлень, навіть не розглядаючи кількісної залежності міжмолекулярної взаємодії від відстані, він отримав так зване Ван-дер-ваальсово рівняння стану реального газу.
Дивитися що таке "Міжмолекулярні взаємодії" в інших словниках:
Міжмолекулярної взаємодії - взаємодій. молекул між собою, що не приводить до розриву або утворення нових хім. зв'язків. М. в. визначає відмінність реальних газів від ідеальних, існування рідин і мол. кристалів. Від М. в. залежать мн. структурні, спектральні, термодинамич ... Хімічна енциклопедія
НЕВАЛEНТНИЕ Взаємодія - взаємодії атомів, не пов'язаних хім. зв'язком. У класичні. теорії хім. будови для геом. конфігурацій молекули, близьких до рівноважної, передбачається можливим альтернативне поділ взаємодій всіх атомів, що утворюють молекулу, на два ... ... Хімічна енциклопедія
Сили Ван-дер-Ваальса - Ван дер ваальсові сили сили міжмолекулярної (і межатомного) взаємодії з енергією 10 20 кДж / моль. Цим терміном спочатку позначалися все такі сили, в сучасній науці він звич ... Вікіпедія
Міжмолекулярної взаємодії - міжмолекулярної взаємодії взаємодія між електрично нейтральними молекулами або атомами. Вперше були враховані Я. Д. Ван-дер-Ваальса в 1873 році. Облік міжмолекулярних сил необхідний для пояснення властивостей реальних газів і ... ... Вікіпедія
МОЛЕКУЛЯРНІ КOМПЛЕКСИ - (донорно акцепторні комплекси, мовляв. З'єднання), утворюються з формально валентно насичений. молекул завдяки силам міжмолекулярної взаємодії. Суч. уявлення про М. к. значно ширше того, що закладено в їх назві, т. к. в М. к. можуть ... ... Хімічна енциклопедія
Міжатомної взаємодії - взаємодія між атомами як вільними, так і входять до складу однієї або різних молекул, кристалів і т. Д. М. в. може бути до про в а л е н т н и м, і о н н и м, м е т а л л і ч е с к и м, типу в о д о р о д н о м з в я з і та в а н д е р в ... ... Фізична енциклопедія
МОЛЕКУЛЯРНІ СПЕКТРИ - спектри випускання, поглинання і комбінаційного розсіювання світла (КРС), що належать вільним або слабо зв'язаним між собою молекулам. Типові М. с. смугасті, вони спостерігаються у вигляді сукупності більш-менш вузьких смуг в УФ, видимої і ... ... Фізична енциклопедія
МОЛЕКУЛЯРНІ КРИСТАЛИ - утворені молекулами, пов'язаними ван дер ваальсовими силами (див. Міжмолекулярні взаємодії). Усередині молекул атоми з'єднані істотно більш міцними (ковалентними) зв'язками. Фазові переходи М. к. Плавлення, сублімація, поліморфні переходи ... ... Хімічна енциклопедія
Молекула - (новолат. Molecula, зменшувальне від лат. Moles маса) найменша частинка речовини, що володіє його хімічними властивостями. М. складається з атомів, точніше з атомних ядер, що оточують їх внутрішніх електронів і зовнішніх валентних електронів, ... ... Велика радянська енциклопедія