Сірка - хімічний елемент, розташований в третьому періоді вVIA групі Періодичної таблиці Д.І. Менделєєва.
Порядковий номер - 16. Будова атома показано на рис. 1. Неметали p-сімейства.
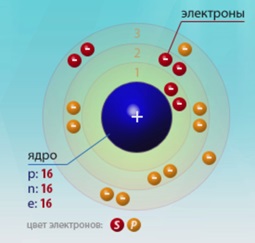
Мал. 1. Схема будови атома сірки.
У звичайних умовах сірка являє собою тендітні кристали жовтого кольору, що плавляться при температурі 112,8 o C. Щільність 2,07 г / см 3. нерозчинні в воді, але досить добре розчинна в сероуглероде, бензолі і деяких інших рідинах. При випаровуванні цих рідин сірка виділяється з розчину у вигляді прозорих жовтих кристалів ромбічної системи, що мають форму октаедрів (ромбічна модифікація).
Якщо розплавлену сірку повільно охолоджувати і в той момент, коли вона частково твердне злити ще не встигла застигнути рідину можна отримати довгі темно-жовті голчасті кристали моноклінної системи (моноклінна модифікація). Щільність 1,96 г / см 3. Температура плавлення 119,3 o C.
Молярна маса сірки дорівнює 32,065 г / моль. Дане значення показує відношення маси речовини (m) е число моль даної речовини (n), позначається M і може бути розрахована за формулою:
Іншими словами, молярна маса речовини - це маса 1 моль даної речовини, виражена в г / моль або ккмоль.
Оскільки незалежно від модифікації сірка знаходиться в твердому або рідкому стані, але не газоподібному, для знаходження значення її молярної маси не можна використовувати величину молярного об'єму або проводити розрахунки за формулою Менделєєва-Клапейрона.
Приклади розв'язання задач
Яка маса сірки потрібно для отримання сульфіду алюмінію Al2 S3 масою 30 г? В яких умовах може бути отриманий цей сульфід з простих речовин?
Запишемо рівняння реакції одержання сульфіду сірки:
Обчислимо кількість речовини сульфіду алюмінію (молярна маса - 150 г / моль):
Відповідно до рівняння реакції n (Al2 S3). n (S) = 1: 3, означає:
n (S) = 3 × 0,2 = 0,6 моль.
Тоді маса сірки буде дорівнює (молярна маса - 32г / моль):
m (S) = n (S) × M (S);
m (S) = 0,6 × 32 = 19,2г.