У разі анодного контролю швидкість корозії знижується при зростанні концентрації іонів металу поблизу поверхні. При цьому може відбуватися утворення важко розчинних солей, які, екрануючи поверхню металу, викликають дифузійні труднощі в протіканні анодного реакції.
Гальмування анодного реакції можливо в результаті пасивації металу при контакті з сильним окислювачем. Пасивний стан металу характеризується ознаками:
· Зміщенням потенціалу металу в позитивну сторону;
· Швидкість корозії значно знижена і постійна в часі.
Виникнення пасивного стану залежить від природи металу, його властивостей, виду агресивного середовища (концентрації окислювача, вмісту розчиненого кисню), температури, швидкості перемішування електроліту. Порушення пасивного стану називається перепассіваціей.
Боротися з перепассіваціей можна, зміщуючи потенціал металу в негативну сторону, зменшуючи концентрацію окислювача, додаючи відновник, або шляхом катодного поляризації металу зовнішнім джерелом струму.
Вплив різних факторів на швидкість електрохімічної корозії.
Вплив температури.
Підвищення температури полегшує дифузію речовин, що беруть участь в електродних процесах. Температура впливає на концентрацію в агресивних середовищах речовин, які беруть участь в електродних процесах. Корозія в нейтральних середовищах з кисневою деполяризацією знижується з ростом температури через деаерації розчиненого кисню. Зміна температури може знижувати захисні властивості плівок з вторинних продуктів (оксидів, гідроксидів, важко розчинних солей), а також змінювати тип полярності металевих захисних покриттів: цинкове покриття на вуглецевої сталі поводиться як анодна, а в гарячій воді - як катодного. Підвищення температури може призвести як до інтенсифікації, так і до уповільнення процесу корозії.
Вплив pH середовища.
За впливом pH середовища метали поділяють на групи:
1. Метали з високу корозійну стійкість в кислотних, лужних і нейтральних розчинах (такі як Au, Pt, Ag). Їх швидкість корозії не залежить від pH середовища (Рис. 1 а).
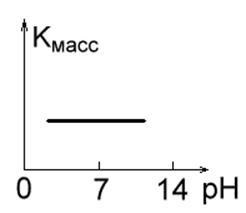
Мал. 1 а. Мал. 1 б.
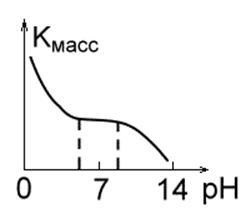
2. Метали, малостойкие в кислотних середовищах, такі як Fe, Mg, Cu, Mn. При невеликих значеннях pH швидкість їх руйнування велика, легко виділяється водень, і утворюються розчинні продукти корозії. В інтервалі pH = 4.0¸8.5 швидкість корозії цих металів постійна. При pH ³ 10 утворюються нерозчинні гідроксиди, і швидкість корозії різко падає (рис.1 б.).
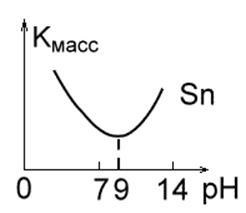
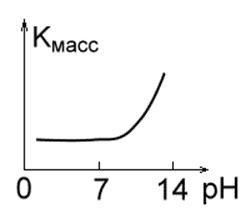
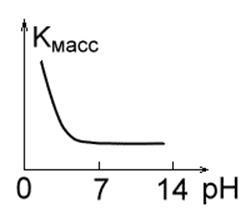
Мал. 1 ст. Мал. 1 г.Ріс. 1 д.
3. Метали, стійкі в нейтральних середовищах, але руйнуються в лужних і кислотних розчинах через їх амфотерности (Рис. 1 ст). Це Zn, Al, Sn, Pb. Для них характерно певне значення pH розчину, при якому швидкість корозії мінімальна: Al - 7.0; Pb - 8.0; Sn - 9.0; Zn - 10.0; Fe - 14.0.
4. Метали, стійкі в кислотних, але нестійкі в лужних середовищах: Mo, Ta, W. (Рис. 1 р).
5. Метали, малостойкие в кислотних середовищах, але стійкі в лужних: Ni, Cd. (Рис. 1 д).
Вплив тиску на швидкість електрохімічної корозії
Вплив тиску носить складний характер. Через зростання швидкості дифузії кисню спочатку корозія збільшується, потім швидкість корозії зменшується, так як на поверхні металу утворюється захисна плівка. Швидкість корозії різко зростає внаслідок механічного видалення захисної плівки, що рухається потоком електроліту. Швидкість руху електроліту більш сильно впливає на корозію з кисневою деполяризацією, ніж з водневої.
Вплив складу електроліту.
Із зростанням концентрації розчину швидкість корозії спочатку збільшується, а потім зменшується. Збільшення корозії пояснюється збільшенням електричної провідності розчину (посилення анодної реакції), а зменшення корозії пов'язано зі зниженням розчинності кисню.