Термодинамічна стійкість даного з'єднання визна-ляется зміною енергії Гіббса AG при утворенні його в даних фізичних умовах (р, Т). Розкладання цього соеди-вати вимагає витрати такої ж енергії і тим самим визна-ляють можливості даного металургійного процесу.
В області високих температур з'єднання металів з елементів-тарний окислювачами (О, S, N, Н) можуть розкладатися, виділяючи окислювач в газову фазу, наприклад:
2FеОтц * = ± 2Fетв Ч - 02газ f •
Рівняння реакцій взаємодії між металом і окисли-телем зручно записувати як реакцію розкладання, визначаючи коефіцієнти рівняння таким чином, щоб в лівій частині виходила одна газова молекула, наприклад:
В цьому випадку стандартне зміна енергії Гіббса AG0 буде для всіх реакцій виражатися загальним рівнянням :.
AG ° = AH-TAs = - RTnN02, (9.1)
а так як вираження для визначення констант рівноваги будуть ідентичні, то їх зручно зіставляти між собою при визначенні напрямку взаємодії з'єднань між собою в металургійних процесах. Гетерогенна система, в ко-
торою існує дане рівновагу (рис. 9.1), буде мати одну ступінь свободи: С = 2 + 2 - 3 = 1, т. е.
р02 = МП або Т = / Др02). (9.2)
Залежність AG від температури в певних межах (без фазових перетворень) змінюється лінійно, а логарифм давши-лення кисню буде змінюватися по кривій, як це показано на рис. 9.2. Точка перетину з віссю температур буде відпо-відати умові:
AG ° = 0; lgA ^ O2 = 0 або ись = 1. (9.3)
Фізичний сенс полягає в тому, що при температурі Те рівноважний тиск кисню над оксидом буде дорівнює зовнішньому тиску чистого кисню, т. Е. Навіть в чистому киць-лороде метал окислюватися не буде. Для активних металів ця температура дуже висока і лежить вище температури ки-співу металу, а метали менш активні, наприклад мідь, задовольняють цій умові при більш низьких температурах.
Застосовуючи спрощене рівняння для стандартного зміни енергії Гіббса AG0 (див. П. 8.3), можна отримати наступні рівняння для дисоціації оксидів:
2. Cu20 ^ 4Cu + 02; AG £ U20 = 334 720 - 150,37 Т
2Fe + 02; ДСре0 = 527 360 - 114,75 т;
Рис 9 1 Система взаємодії-дії металу з кисло-родом
2MnO ^ 2Мп + 02; А0 ^ пО = 769 860 - 148,05 т; SiCWSi + 02; AGsi02 = 1 718 600 181,66 Г; 2 / зА12Оа ** 4 / за1 + 02; AG £, = 1 116600 - 209,11 Т.
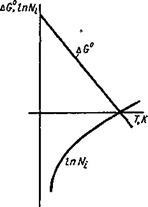
Рис 9 2. Залежність ДС ° і ло-гаріфма тиску дисоціації оксиду металу від температури
Мал. 9 3 Зміна ДС ° в залежності Рис 9 4 Схема металотермічних від температури для АЬОз, S1O2, відновлення оксидів металу при MnO, FeO, CU2O Т = const
На рис. 9 3 наведені графіки функцій AG ° => (T). Термо-динамічна стійкість оксидів зростає в ряду елементів Cu-> Fe - * - Mn - * - Si - * - Al, але в інтервалі температур 2500. 3000 До стійкості оксидів Мп і Si міняються місцями. Температури, при яких термодинамічна стійкість звертається в нуль, відповідно будуть наступними: Тсщо = 2230 К; 7Veo = = 4600 К; 7'мпо = 5200 К; Ts, 02 = 4730 К; ГАІ2о3 = 5330 К (це орієнтовні дані, отримані дуже наближеним розрахунком).
Термодинамічна стійкість істотно змінюється в залежності від парціального тиску газоподібного продукту реакції в навколишньому середовищі.
Якщо для оксиду заліза при температурі 4600 К AGpe0 = 0 при тиску р = 1,013-105 Па, то при тиску / 7 = 1,33 X X 10
2 Па (10-4 мм рт. Ст.) ДG0 буде дорівнює нулю при темпера-турі
Різна термодинамічна стійкість з'єднань, на-приклад оксидів, дозволяє здійснювати окислювально-восстано-вітельно реакції між ними.
Візьмемо два ізольованих судини при Т = const (рис 9.4). В одному з них знаходиться система 2АО * = ± 2А- | - Cbf, а іншому - 2ВО = f ± 2В + 02f. Припустимо, що AGA0> AGg0, а рівноважні тиску кисню будуть р ^<р'о2. Если сосуды соединить между собой, то кислород будет переходить от оксида ВО к металлу Айв результате получим восстановление металла В в результате окисления А:
Такий процес називається металотермічним.
Аналогічно дисоціації оксидів можна розглянути процес-си дисоціації сульфідів, нітридів і гідридів металів, що в такій же мірі буде визначати їх термодинамічну устої-тична. При з'єднанні з елементарними окислювачами (О, S, N, Н, галогени) елементи можуть проявляти різну ступінь окислення і дисоціація з'єднань буде відбуватися ступен-чато від вищого ступеня окислення до нижчої, наприклад:
4 / зСг03 ^ 2 / зСг20з + 02f; 2Cr2035 = t 4Cr0 + 02f; 2СЮ ^ 2Сг +
2FeS2 ^ 2FeS + S2f; 2FeS ^ 2Fe + S2f;
SF6 ^ SF4 + F2f; SF4 ^ SF2 + F2t і т. Д.
Термодинамічна стійкість з'єднань сильно увеличи-ється, якщо ці з'єднання знаходяться в розчинах.