

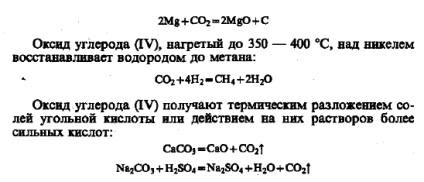
Оксид вуглецю (II) (чадний газ) - безбарвний газ, без запаху в смаку, погано розчинний у воді. Температура плавлення - 205 ° С, температура кипіння - 191 ° С, відносна молекулярна маса СО дорівнює 28, тому він мало відрізняється щільніше від повітря. Чадний газ - отруйна речовина. Отруєння в легкій формі супроводжується запамороченням, головним болем і блювотою. Сильне отруєння призводить до смерті. Отруйна дія СО пояснюється тим, що він утворює більш міцне, ніж кисень, сполуку з гемоглобіном. У зв'язку з цим порушується перенесення кисню від легенів до тканин. Формальна ступінь окислення вуглецю +2 не відображає будову молекули СО. У молекулі СО, крім подвійного зв'язку, утвореної обобществлением електронів вуглецю і кисню, є додаткова, третя зв'язок (зображена стрілкою), утворена за донорно-акцепторного механізму за рахунок непо-поділеній пари електронів кисню: У зв'язку з цим молекула СО міцна. Оксид вуглецю (II) є несолеобразующіе і не взаємодіє в звичайних умовах з водою, кислотами і лугами. При підвищених температурах він схильний до реакцій приєднання і окислення - відновлення. На повітрі СО горить синім полум'ям: Він відновлює метали з їх оксидів і солей: Під дією опромінення (на прямому сонячному світлі) або в присутності каталізаторів СО з'єднується з С12, утворюючи фосген - вкрай отруйний газ: З багатьма металами СО під тиском утворює леткі карбоніли : Ковалентний зв'язок Me -С в молекулі карбонила утворюється за донорно-акдепторному механізму (докладніше див. § 20.4). При нагріванні карбоніли металів розкладаються на метал і оксид вуглецю (II), що використовується для отримання металів особливої чистоти. У природі оксид вуглецю (II) практично не зустрічається. Він може утворюватися при зневодненні мурашиної кислоти (лабораторний спосіб отримання): Виходячи з останнього перетворення, чисто формально можна вважати СО ангідридом мурашиної кислоти. Це підтверджується наступною реакцією, яка відбувається при пропущенні СО в розплав лугу при високому тиску: Оксид вуглецю (IV) (діоксид вуглецю, вуглекислий газ) - газ без кольору і запаху, на смак злегка кислуватий, який не підтримує дихання і горіння. Він добре розчинний у воді (88 обсягів С02 в 100 об'ємах Н20 при 293 К). При звичайній температурі під тиском 60 атм діоксид вуглецю переходить в рідину. При охолодженні до - 76 ° С оксид вуглецю (IV) перетворюється в тверду білу масу, звану сухим льодом. Тверда двоокис вуглецю переходить в газоподібний стан (сублімує), минаючи рідке. Відносна молекулярна маса діоксиду вуглецю дорівнює 44, тому він в 1,52 рази важчий за повітря. При великій концентрації оксиду вуглецю (ГУ) в повітрі люди і тварини задихаються. При вмісті в повітрі 3% у людини спостерігається прискорене дихання, 10% - втрата свідомості і смерть, при 20% - миттєвий параліч. Оксид вуглецю (IV) як кислотний оксид взаємодіє з основними оксидами і лугами: При розчиненні в воді діоксид вуглецю взаємодіє з нею (менше 1% від розчиненого кількості) з утворенням вкрай слабкою і нестійкою вугільної кислоти: Про її слабкості говорить і той факт, що із з'єднань вона витісняється навіть оцтовою кислотою: Вуглекислий газ здатний виступати окислювачем; при нагріванні з вуглецем утворюється чадний газ: Запалена на повітрі стрічка металевого магнію продовжує жменю в атмосфері С02: Оксид вуглецю (IV), нагрітий до 350 - 400 ° С, над нікелем відновлює воднем до метану: Оксид вуглецю (IV) отримують термічним розкладанням солей вугільної кислоти або дією на них розчинів більш сильних кислот: