2.2 Склад земної кори
Вперше склад твердої частини земної кори в вагових відсотках підрахував американський дослідник Ф. Кларк в 1889 р Велика робота по уточненню отриманих цифр була пророблена В. І. Вернадським, А. Е. Ферсманом, І. і В. Ноддак, Г. Гевеш, В. М. Гольдшмідт і А. П. Виноградовим. Останній підрахував середній хімічний склад лише літосфери (без урахування гідросфери та атмосфери).
З більш ніж ста хімічних елементів, наведених в періодичній таблиці елементів Менделєєва, лише мало хто користується широким розповсюдженням в земній корі. Такі елементи в таблиці розташовуються переважно у верхній її частині, т. Е. Відносяться до числа елементів з малими порядковими номерами.
Найбільш поширеними елементами є: О, Si, Al, Fe, Ca, Na, К, Mg, Ti, H і С. На частку всіх інших елементів, що зустрічаються в земній корі, доводиться всього лише кілька десятих відсотка (за вагою). Переважна більшість цих елементів в земній корі присутній майже виключно у вигляді хімічних сполук. До числа елементів, що зустрічаються в самородному вигляді, відносяться далеко не всі. Одні й другі виникають в результаті хімічних реакцій, які протікають в земній корі при різних геологічних процесах, що призводять до утворення найрізноманітніших па складу масивів гірських порід і родовищ корисних копалин.
Багато із зазначених рідкісних в земній корі елементів під вліяніемсовершающіхся в природі геохімічних процесів нерідко образуютісключітельно багаті скупчення мінеральної речовини, що носять назву рудних родовищ. Якби не існувало процесів, що призводять до утворення таких родовищ, які мала б смислразрабативать з метою вилучення цінних для промисловості металів, то можна з упевненістю сказати, що не було б і настільки мощногоразвітія техніки і культури, яке спостерігається в даний час.
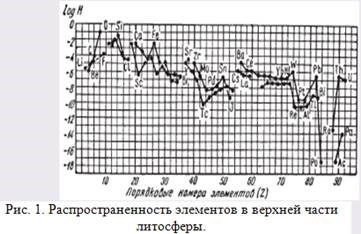
Мал. 1. Поширеність елементів у верхній частині літосфери.
Тоді багато метали, витягнуті з порід в лабораторних умовах, були б виключно дорогими. Дуже характерно, що кларкітакіх металів, як ванадій, цезій, галій та ін. У багато разів вище кларков ртуті, вісмуту, срібла, золота та ін. Але, незважаючи на їх досить ценниесвойства, вони не поширені в людському побуті, так як їх родовища з промисловими концентраціями в природі вкрай рідкісні.
Природні сполуки важких металів є в основному порівняно прості сполуки. Частина цих елементів (Fe, Mn, Sn, Сr, W, Nb, Та, Th, U) переважно поширена у вигляді кисневих сполук, але зате багато інших елементів (Fe, Ni, Co, Zn, Cu, Pb, Hg, Mo , Bi, As, Sb, Ag і ін.) зустрічаються головним чином у вигляді скупчень сірчистих, мишьяковистих і вмістом сурми з'єднань. Железосовмещает в собі властивості сідерофільних, літофільних і халькофільних елементів, володіючи помітною спорідненістю як до кисню, так і до сірки.
На діаграмі (рис. 1) данилогаріфми атомних кларков (H) як функція порядкового номера (Z), причому кисень прийнятий за одиницю.
На діаграмі по осі абсцис розташовані порядкові номери хімічних елементів, а по осі ординат - логарифми їх атомнихкларков. Можна бачити, що зі збільшенням порядкового номера крівиекларков як парних, так і непарних елементів в загальному обнаружіваюттенденцію до зниження. Це означає, що для більшості хіміческіхелементов має місце обернено пропорційна залежність їх середнього вмісту в земній корі від порядкового номера, хоча встречаютсяі виключення (наприклад, для Li, Be, В і ін.).
3.1 Загальні відомості
Чудовою особливістю багатьох природних сполук є їх забарвлення. Для ряду мінералів вона постійна і досить характерна. Наприклад, кіновар (сірчиста ртуть) завжди має кармін-крассная кольором, для малахіту характерна яскраво-зелене забарвлення, кубічні кристали піриту легко впізнаються по металево-золотистого кольору і т. Д. Поряд з цим забарвлення великої кількості мінералів мінлива. Такі, наприклад, різновиди кварцу: безбарвні (прозорі), молочнообелие, желтоватообурие, майже чорні, фіолетові, рожеві.
Блиск - також вельми характерна ознака багатьох мінералів. В одних випадках він дуже схожий на блиск металів (галеніт, пірит, арсенопірит), в інших - на блиск скла (кварц), перламутру (мусковіт). Чимало й таких мінералів, які навіть в свіжому зламі виглядають матовими, т. Е. Не мають блиску.
Всі властивості мінералів (фізичні та ін.), Знаходяться в причинному залежності від особливостей хімічного складу і кристалічної структури речовини - від конституції минее рала, що, в свою чергу, обумовлено розмірами атомів або іонів (беруть участь у складі мінералу), будовою їх електронних оболонок (особливо зовнішніх) і властивостями, які визначаються становищем хімічних елементів в системі Д. І. Менделєєва. Тому багато з того, що раніше здавалося загадковим, тепер, в світлі сучасних досягнень точних наук, стає все більш і більш зрозумілим. Ці досягнення сприяють не тільки правильного розуміння природних явищ, а й допомагають нам в практичному використанні властивостей мінералів.
Конституція мінералу є єдність його хімічного складу і кристалічної структури. Поняття "конституція" описує, можна сказати, сутність мінералу; вона є його власним, внутрішнім властивістю, на відміну від інших властивостей і ознак, які є відгуками на зовнішні впливи, що проявляються і формуються у взаємодії з середовищем. Саме конституція мінералу визначає його видову приналежність, діагностичні ж властивості (ознаки) мінералів, які є функцією його складу і структури, служать для встановлення видової приналежності.
Переважна більшість зустрічаються в природі мінералів представлено хімічними сполуками. Серед останніх розрізняють:
· А) сполуки постійного складу (Дальтоніди) і
· Б) з'єднання змінного складу.
3.2.1 З'єднання постійного складу
Всі хімічні сполуки постійного складу, як відомо, строго підкоряються закону кратних відносин (закон Дальтона) і закону валентних паїв, що зв'язує відносини компонентів даного з'єднання з відносинами їх в інших типах з'єднань. Ці закони знаходяться в повній відповідності з Періодичної системи елементів Д. І. Менделєєва, законами кристаллохимии і вченням про симетрії в кристалічних середовищах.
Характерно, що ці сполуки відрізняються цілим рядом особливих фізичних властивостей, чітко виступають на фізико-хімічних діаграмах плавкості, розчинності, електропровідності, твердості, питомої ваги, показників заломлення і ін.
Лише окремі індивіди мінералів, що формуються в специфічних умовах природного дистиляції, наближаються до з'єднань постійного складу. Проте як ідеалізації багато мінералів корисно умовно розглядати як з'єднання постійного складу.
Таке абстрагування від реального складу дозволяє використовувати поняття мінерального виду і характеризувати індивіди мінералів, що відносяться до певного мінеральному виду, єдиних і відносно простими хімічними формулами, що відображають стійкі особливості їх, взагалі кажучи, непостійного складу.
До числа бінарних хімічних сполук відносяться:
Сполуки, що складаються з атомів трьох елементів, називаються тернарного; такі різні кисневі солі.
Існують, звичайно, і з'єднання більш складного складу.
Хімічний склад хімічних сполук може зображуватися двояким способом:
1) у вигляді емпіричних формул;
2) у вигляді конституційних або структурних формул.
Крім бінарних і тернарних хімічних сполук, в природі поширені і більш складні з'єднання, наприклад, подвійні солі. Подвійними солями називаються такі сполуки постійного складу, які складаються як би з двох простих солей, присутніх в кратних відносинах. У більшості випадків ці солі є подвійними по катіонів, рідше - по анионам або одночасно по катіонів і аніонів. Як приклади можуть бути наведені такі:
Крім хімічних сполук постійного складу, одержуваних зазвичай в лабораторіях з використанням чистих вихідних компонентів, існує величезна безліч таких з'єднань, склад яких не є постійним, а коливається то в вузьких, то в більш широких межах, причому ці коливання складу не можуть бути пояснені наявністю будь -або механічних домішок сторонніх речовин. Навпаки, коливається склад з'єднань з крісталлохимічеськой точки зору знаходить пояснення в розчинності складових компонентів в даному з'єднанні.
Такі хімічні освіти отримали назву з'єднань змінного складу.
Серед мінералів з'єднання змінного складу становлять більшість. Існування речовин (фаз) змінного складу здається цілком природним, якщо мова йде про рідких розчинах, склад яких визначається співвідношенням кількостей розчиненого речовини і розчинника. Таким чином, склад розчину коливається в межах від чистого розчинника до насиченого розчину; він може бути будь-яким з безперервного безлічі можливих складів в межах, що залежать від температури і тиску. Здатність кристалічних речовин різного складу утворювати безперервно мінливі за складом з'єднання однаковою кристалічної структури заснована на ізоморфізмі, т. Е. Властивості атомів різних елементів заміняти один одного в твердих хімічних сполуках.
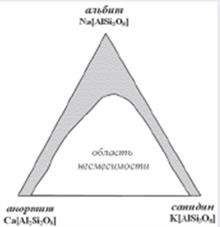
Системи з ізоморфними заміщеннями можуть бути і більш ніж двокомпонентними. У разі таких систем мова вже йде не про рядах, а про полях і цілих областях изоморфной смесімості, як це характерно, наприклад, для польового шпату (рис. 2) при високих температурах, коли змішання піддаються плагіоклази і калієві польові шпати.
Іонні радіуси в вертикальних групах періодичної системи елементів зростають зі збільшенням порядкового номера і зменшуються в горизонтальному напрямку зі збільшенням номера групи (т. Е. Зі збільшенням валентності). На цій підставі А. Е. Ферсманом виведений закон діагональних рядів ізоморфних іонів в Періодичній системі елементів, справедливий для лівої її частини. Намічаються наступні гетеровалентності ряди ізоморфізму іонів (в дужках показані іонні радіуси в ангстремах):
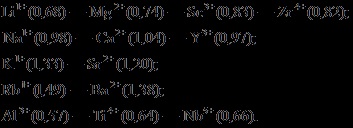
Дійсно, в природних з'єднаннях нерідко спостерігаються, що літієві мінерали, наприклад, містять ізоморфні домішки магнію, магнієві мінерали - домішки скандію, натрієві - домішки кальцію, кальцієві - домішки ітрію і т. Д.
До числа водних з'єднань слід відносити тільки такі, які в своєму складі містять електрично нейтральні молекули води.
Залежно від того, яким способом утримується вода в мінералах, розрізняють:
1) кристаллизационную, або пов'язану, воду, що входить в кристалічні структури мінералів;
2) вільну воду, не бере участь в будові самого кристалічної речовини.
Пов'язана вода в кристалічній структурі бере участь у вигляді молекул Н2О, що займають в ній строго певні місця. Кількість молекул води знаходиться в простих відносинах до інших компонентів сполуки. Як приклади можна навести такі: Na2CO3. 10H2O (сода), Ca [SО4]. 2H2O (гіпс), Ni3 [AsO4] 2. 8H2O (анабергіт), Аl2 [РО4] (ОН) 3. 5Н2О (вавеліт)
Це так звані кристалогідрати, які, по Вернеру, повинні розглядатися як "комплексні сполуки", т. Е. Такі, в яких молекули води як структурні одиниці розташовуються в певній координації навколо будь-яких іонів, створюючи таким шляхом свого роду комплексні іони.
Вільна вода, присутня в мінеральних масах, характеризується тим, що не приймає прямої участі в будові кристалічної речовини мінералів. При нагріванні вона виділяється поступово.
Розрізняють три види вільної води:
2. М.П. Шаськольськая "Кристалографія" - М, "Вища школа", 1984.
4. Булах А.Г. "Мінералогія з основами кристалографії" - М, Недра, 1989.