Для захисту металів від корозії застосовуються різні способи, які умовно можна розділити на наступні основні напрямки: легування металів; захисні покриття (металеві, неметалеві); електрохімічний захист; зміна властивостей корозійного середовища; раціональне конструювання виробів.
Легування металів. Це ефективний метод підвищення корозійної стійкості металів. При легуванні до складу сплаву або металу вводять легуючі елементи (хром, нікель, молібден і ін.), Що викликають пасивність металу. Пасивацією називають процес переходу металу або сплаву в стан його підвищеної корозійної стійкості, викликане гальмуванням анодного процесу. Пасивний стан металу пояснюється утворенням на його поверхні було зроблено на структурі оксидної плівки (оксидна плівка має захисні властивості за умови максимальної схожості кристалічних решіток металу і утворюється оксиду).
Широке застосування знайшло легування для захисту від газової корозії. Легування піддаються залізо, алюміній, мідь, магній, цинк, а також сплави на їх основі. В результаті чого виходять сплави з більш високу корозійну стійкість, ніж самі метали. Ці сплави мають одночасно жаростойкостью і жароміцних.
Жаростійкість - стійкість по відношенню до газової корозії при високих температурах. Жароміцність - властивості конструкційного матеріалу зберігати високу механічну міцність при значному підвищенні температури. Жаростійкість зазвичай забезпечується легуванням металів і сплавів, наприклад, стали хромом, алюмінієм і кремнієм. Ці елементи при високих температурах окислюються енергійніше, ніж залізо, і утворюють при цьому щільні захисні плівки оксидів, наприклад Al2 O3 і Cr2 O3.
Легування також використовується з метою зниження швидкості електрохімічної корозії, особливо корозії з виділенням водню. До корозійностійким сплавів, наприклад, відносяться нержавіючі стали, в яких легирующими компонентами служать хром, нікель і інші метали.
Захисні покриття. Шари, штучно створювані на поверхні металевих виробів для захисту їх корозії, називаються захисними покриттями. Нанесення захисних покриттів - найпоширеніший метод боротьби з корозією. Захисні покриття не тільки захищають вироби від корозії, але і надають поверхням ряд цінних фізико-хімічних властивостей (зносостійкість, електричну провідність і ін.). Вони підрозділяються на металеві та неметалеві. Загальними вимогами для всіх видів захисних покриттів є висока адгезійна здатність, суцільність і стійкість в агресивному середовищі.
Металеві покриття. Металеві покриття займають особливе становище, так як їх дія має двоїстий характер. До тих пір, поки цілісність шару покриття не порушена, його захисна дія зводиться до ізоляції поверхні, що захищається металу від навколишнього середовища. Це не відрізняється від дії будь-якого механічного захисного шару (забарвлення, оксидна плівка і т.д.). Металеві покриття повинні бути непроникні для корозійних агентів.
При пошкодженні покриття (або наявності пір) утворюється гальванічний елемент. Характер корозійного руйнування основного металу визначається електрохімічними характеристиками обох металів. Захисні антикорозійні покриття можуть бути катодними і анодними. До катодних покриттів відносяться покриття, потенціали яких в даному середовищі мають більш позитивне значення, ніж потенціал основного металу. Анодні покриття мають найбільш негативний потенціал, ніж потенціал основного металу.
Так, наприклад, по відношенню до заліза нікелеве покриття є катодних, а цинкове - анодним (рис. 2.).
При пошкодженні нікелевого покриття (рис. 2, а) на анодних ділянках відбувається процес окислення заліза внаслідок виникнення мікрокоррозіонних гальванічних елементів. На катодних ділянках - відновлення водню. Отже, катодні покриття можуть захищати метал від корозії лише за відсутності пір і пошкодження покриття.
Місцеве пошкодження захисного цинкового шару веде до подальшого його руйнування, при цьому поверхню заліза захищена від корозії. На анодних ділянках відбувається процес окислення цинку. На катодних ділянках - відновлення водню (рис. 2, б).
Електродні потенціали металів залежать від складу розчинів, тому при зміні складу розчину може змінюватися і характер покриття.
Для отримання металевих захисних покриттів застосовуються різні способи: електрохімічний (гальванічні покриття); занурення в розплавлений метал (гаряче цинкування, лудіння); металізація (нанесення розплавленого металу на поверхню, що захищається за допомогою струменя стиснутого повітря); хімічний (отримання металевих покриттів за допомогою відновників, наприклад гідразину).
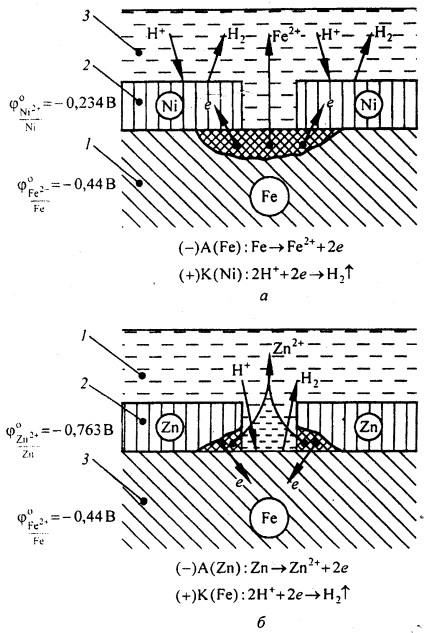
Мал. 2. Корозія заліза в кислотному розчині з катодних (а) і анодним (б) покриттями: 1 - основний метал; 2 - покриття; 3 - розчин електроліту.
Матеріалами для металевих захисних покриттів можуть бути як чисті метали (цинк, кадмій, алюміній, нікель, мідь, хром, срібло та ін.), Так і їхні сплави (бронза, латунь та ін.).
Неметалеві захисні покриття. Вони можуть бути як неорганічними, так і органічними. Захисна дія цих покриттів зводиться в основному до ізоляції металу від навколишнього середовища.
Як неорганічні покриттів застосовують неорганічні емалі, оксиди металів, з'єднання хрому, фосфору та ін. До органічних відносяться лакофарбові покриття, покриття смолами, пластмасами, полімерними плівками, гумою.
Неорганічні емалі за своїм складом є силікатами, тобто сполуками кремнію. До основних недоліків таких покриттів відносяться крихкість і розтріскування при теплових і механічних ударах.
Лакофарбові покриття найбільш поширені. Лакофарбове покриття повинне бути суцільним, газо-і водонепроникним, хімічно стійким, еластичним, мати високий зчепленням з матеріалом, механічною міцністю і твердістю.
Хімічні способи дуже різноманітні. До них відноситься, наприклад, обробка поверхні металу речовинами, що вступають з ним в хімічну реакцію і утворюють на його поверхні плівку стійкого хімічної сполуки, в формуванні якої бере участь сам захищається метал. До числа таких способів відноситься оксидування. фосфатирование, сульфіт-дирования і ін.
Оксидування - процес утворення оксидних плівок на поверхні металевих виробів.
Сучасний метод оксидування - хімічна і електрохімічна обробка деталей в лужних розчинах.
Для заліза і його сплавів найбільш часто використовується лужний оксидування в розчині, що містить NaOH, NaNO3. NaNO2 при температурі 135-140 Про С. Оксидування чорних металів називається воронінням.
На анодних ділянках відбувається процес окислення:
На катодних ділянках відбувається процес відновлення:
2 Н2 О + О2 + 4

На поверхні металу в результаті роботи мікрогальваніческіх елементів утворюється Fe (OH) 2. який потім окислюється в Fe3 O4. Оксидна плівка на маловуглецевої сталі має глибокий чорний колір, а на високовуглецевої сталі - чорний з сіруватим відтінком.
Fe 2+ + 2OH -
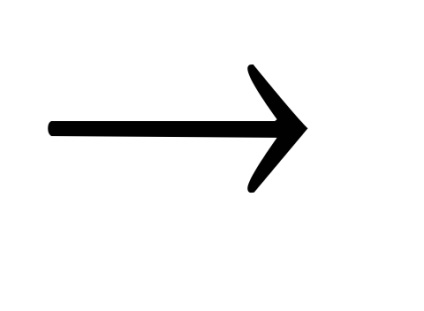
12 Fe (OH) 2 + NaNO3
Протикорозійні властивості поверхневої плівки оксидів невисокі, тому область застосування цього методу обмежена. Основне призначення - декоративне оздоблення. Вороніння використовується в тому випадку, коли необхідно зберегти початкові розміри, так як оксидна плівка становить всього 1,0 - 1,5 мікрона.
Фосфатирование - метод отримання фосфатних плівок на виробах з кольорових і чорних металів. Для фосфатирования металевий виріб занурюють в розчини фосфорної кислоти і її кислих солей (H3 PO4 + Mn (H2 PO4) 2) при температурі 96-98 о С.
На поверхні металу в результаті роботи мікрогальваніческіх елементів утворюється фосфатная плівка, яка мають складний хімічний склад і містить малорозчинні гідрати дво- і трьох заміщених фосфатів марганцю і заліза: MnHPO4. Mn3 (PO4) 2. FeHPO4, Fe3 (PO4) 2 n H2 O.
На анодних ділянках відбувається процес окислення:
На катодних ділянках відбувається процес відновлення водню:
2Н + + 2


При взаємодії іонів Fe 2+ з аніонами ортофосфорної кислоти і її кислих солей утворюються фосфатні плівки:
Fe 2+ + H2 PO - 4
3Fe 2+ + 2 PO4 3
Утвориться фосфатная плівка хімічно пов'язана з металом і складається з зрощених між собою кристалів, розділених порами ультрамікроскопічних розмірів. Фосфатні плівки мають гарну адгезію, мають розвинену шорстку поверхню. Вони є хорошим ґрунтом для нанесення лакофарбових покриттів і просочують мастил. Фосфатні покриття застосовуються в основному для захисту металів від корозії в закритих приміщеннях, а також як метод підготовки поверхні до подальшої забарвленням або покриття лаком. Недоліком фосфатних плівок є низька міцність і еластичність, висока крихкість.
Анодування - це процес утворення оксидних плівок на поверхні металу і перш за все алюмінію. У звичайних умовах на поверхні алюмінію присутній тонка оксидна плівка оксидів Al2 O3 або Al2 O3 ∙ nH2 O, яка не може захистити його від корозії. Під впливом навколишнього середовища алюміній покривається шаром продуктів корозії. Процес штучного утворення оксидних плівок може бути здійснений хімічним і електрохімічним способами. При електрохімічному оксидуванні алюмінію алюмінієве виріб грає роль анода електролізера. Електролітом служить розчин сірчаної, ортофосфорної, хромової, борної або щавлевої кислот, катодом може бути метал, що не взаємодіє з розчином електроліту, наприклад нержавіюча сталь. На катоді виділяється водень, на аноді відбувається утворення оксиду алюмінію. Сумарний процес на аноді можна представити таким рівнянням:
2 Al + 3 H2 O