1. ПРИНЦИП МІНІМУМУ ЕНЕРГІЇ
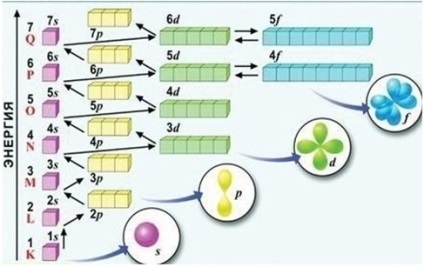
Орбіталі заповнюються в порядку збільшення енергії, від низу до верху. Кожен електрон розташовується так, щоб його енергія була мінімальною, т. Е. Серед вільних орбіталей він вибирає орбиталь з найнижчою енергією.
Порядок заповнення енергетичних підрівнів (див. Рис.) Можна запам'ятати у вигляді ряду: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d » 4f <6p <7s….
2. принципу Паулі
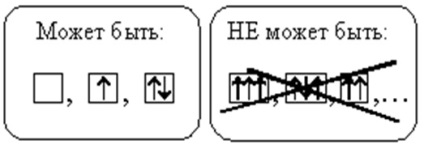
На кожній орбіталі може знаходитися не більше двох електронів. Якщо два електрона знаходяться на одній орбіталі, то вони мають протилежними спинами (стрілки спрямовані в різні боки). Такі електрони називають спареними. Якщо на орбіталі знаходиться тільки один електрон, то його називають неспареним.
3. Правила Гунда (Гунда)
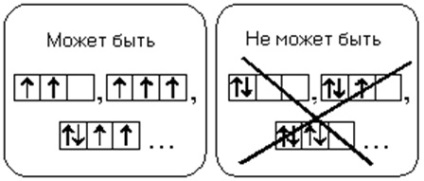
Атом в основному стані повинен мати максимально можливе число неспарених електронів в межах певного підрівня.
Електронна формула атома - запис розподілу електронів по орбіталях в основному (не збудженому) стані атома або його іонів
Принципи побудови ЕЛЕКТРОННОЇ конфігурації ЕЛЕМЕНТА
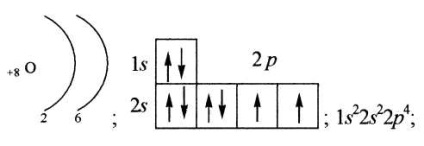
Кількість електронів в атомі елемента дорівнює його порядковому номеру.
Кількість енергетичних рівнів атома дорівнює номеру періоду, в якому розташований елемент.
Кількість електронів на зовнішньому (валентном) рівні дорівнює номеру групи, в якій розташований елемент.
При більш детальному описі електронної конфігурації розглядають не тільки кількість електронів на даному енергетичному рівні, а й їх розподіл по подуровням. Кожна незаповнена орбиталь позначається порожнім квадратиком.
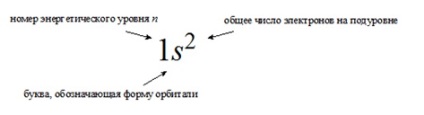
ЗАПИС ЕЛЕКТРОННОЇ конфігурації атома
Докладні електронні конфігурації атомів зображують двома способами:
графічно, за допомогою квадратиків зі стрілками (часто називають енергетичними діаграмами);
в рядок, коли перераховуються всі зайняті енергетичні підрівні із зазначенням загального числа електронів на кожному з них.
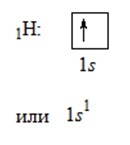
Валентність атома визначається числом неспарених електронів.
При наявності вільних орбіталей електрони атома можуть розпарювати, перескакувати на на інший підрівень, тобто атом переходить у збуджений стан, тому валентність може бути постійної і змінної. При цьому число неспарених електронів, а, отже, число зв'язків, що утворюються атомом, збільшується.
Вища валентність завжди дорівнює номеру групи (виняток: N, O, F).
Для визначення нижчої змінної валентності (кількості вільних електронів). якої найчастіше мають неметали, необхідно з 8 відняти номер групи.
Стан атома, при якому електрон з електронної пари з попереднього підрівні «розпарюється» і переходить на наступний підрівень, називається збудженим станом атома.