§ 1. Теоретичні знання про тепловий ефект. Основні поняття термодинаміки. Тепловий ефект хімічних реакцій. Закони термохімії ........................................ .......... ....... ......................... ….….Стор. 4
§ 2. Експериментальне визначення теплового ефекту ........................... .. ... ..стр. 10
§ 3. Застосування теплового ефекту на практиці. Хімічні «грілки» і охолоджуючі пакети. Жароміцні покриття. Термохимический спосіб обробки алмазу .................................................................................................... Стор.
Як відомо, життя на Землі неможлива без протікання хімічних реакцій. Вони складають основу створення і існування більшості сучасних предметів. Без хімічних реакцій нашу планету не захищав би озоновий шар, в надрах землі не приховували б корисні копалини. Тому хімічні реакції - одна з найважливіших речей на Землі, а їх вивчення - складний, але дуже корисний процес.
Але охопити всю суть хімічних реакцій в одному рефераті неможливо. Можна лише описати якусь їх сторону. Саме тому я і вибрала в якості теми свого дослідження, напевно, один з найцікавіших і вже точно один з найважливіших аспектів хімічних реакцій - парниковий ефект.
Теплові ефекти хімічних реакцій необхідні для багатьох технічних розрахунків. Вони знаходять широке застосування в багатьох галузях промисловості, а також у військових розробках. Знання теплового ефекту також важливо для вирішення багатьох практичних завдань. За допомогою хімічних реакцій з тепловим ефектом в наших квартирах горить газ, йде гаряча вода, є електрика, завдяки саме цьому типу хімічних реакція їздять наші автомобілі, літають ракети і літаки. Всі реакції горіння - суть теплові реакції. Порох, вогнепальну зброю, зварювання та різання металів, промислові лазери ... Хімічні реакції всюди.
Іншими словами, хімічні реакції c тепловим ефектом увійшли в сучасне життя людини і суспільства. Саме тому, що зараз вони є невід'ємною частиною нашого життя, і слід звернути особливу увагу на цю тему. Саме тому ця тема обрана нами для написання реферату.
Мета дослідження - різнобічно вивчити і явище теплового ефекту і можливість його застосування на практиці. Цієї мети можна досягти, вирішивши кілька поставлених нами завдань:
1. Познайомитися з поняттям термодинаміки і її основними аспектами;
2. Вивчити розділ термодинаміки, званий термохімією;
3. Зрозуміти, що таке парниковий ефект і яке його значення в хімії;
4. Дізнатися про різні способи застосування отриманих знань в житті.
§1. Теоретичні знання про тепловий ефект.
Основні поняття термодинаміки.
Термодинаміка (грец. # 952; # 941; # 961; # 956; # 951; - «тепло», # 948; # 973; # 957; # 945; # 956; # 953; # 962; - «сила») - розділ прикладної фізики або теоретичної теплотехніки, в якому досліджується перетворення руху в теплоту і навпаки. У термодинаміки розглядаються не тільки питання поширення теплоти, але і фізичні і хімічні зміни, пов'язані з поглинанням теплоти речовиною, а також, навпаки, виділення теплоти в ході фізичних і хімічних перетворень. [1]
Термодинаміка історично виникла як емпірична (експериментальна) наука про основні способи перетворення внутрішньої енергії тіл для здійснення механічної роботи. Однак в процесі свого розвитку термодинаміка проникла в усі розділи фізики, де можливо ввести поняття «температура» і дозволила теоретично передбачити багато явищ задовго до появи суворої теорії цих явищ.
Хімічна термодинаміка вивчає взаємні перетворення теплоти і енергії в хімічних системах і описує стан хімічної рівноваги. Вона дозволяє судити про те, за яких умов можлива та чи інша реакція. [2]
У цьому розділі ми познайомимося з основними законами і поняттями термодинаміки.
Термодинамічні перетворення підкоряються основним законам термодинаміки - термодинамічних засадам. Всього їх 3, плюс примітка, зване також нульовим початком термодинаміки.
Перший початок термодинаміки - закон збереження енергії для термодинамічних процесів. Він говорить:
Енергія не виникає з нічого і не зникає безслідно, а тільки переходить з однієї форми в іншу.
Енергія буває різною. В курсі фізики розглядають такі її види, як, наприклад, потенційна і кінетична. У хімії важливіше внутрішня енергія речовин (енергія руху їх молекул і атомів). Зміна внутрішньої енергії речовин в ході хімічних реакцій набагато більше зміни їх потенційної і кінетичної енергії. Тому при проведенні лабораторних дослідів ми не кидаємося пробірками з речовинами для більшого зміни їх енергії (що потрібно нам для проведення реакції), а використовуємо інші способи. Частина внутрішньої енергії, пов'язана з рухом електронів в атомах, називається хімічної енергією.
Крім того, в хімічних реакціях важливо знати теплову енергію речовин. Так називають сумарну енергію атомів в молекулі і молекул в цілому. Мірою теплової енергії є температура тіла. Крім того, вона залежить і від агрегатного стану речовини, і від типу молекул. Теплова енергія виділяється, наприклад, коли хімічна енергія вихідних речовин в ході хімічної реакції більше, ніж енергія продуктів.
Закон збереження енергії для хімічних реакцій свідчить:
Теплова енергія, що виділилася в ході хімічної реакції, дорівнює зміні хімічної енергії.
Другий закон термодинаміки має кілька різних, але в той же час еквівалентних формулювань.
1 - Постулат Клаузіуса [3]. Процес, при якому не відбувається інших змін, крім передачі теплоти від гарячого тіла до холодного, є незворотнім, тобто теплота не може перейти від холодного тіла до гарячого без будь-яких інших змін в системі. Це явище називають розсіюванням, або диссипацией, енергії.
2 - Постулат Кельвіна [4]. Процес, при якому робота переходить в теплоту без будь-яких інших змін в системі, є незворотнім, тобто неможливо перетворити в роботу всю теплоту, взяту від джерела з однорідною температурою, не проводячи інших змін в системі.
Хімічні реакції з тепловим ефектом - це так звані самовільні процеси, тобто йдуть самі по собі. До таких процесів відносяться і екзотермічні, і ендотермічні реакції.
Однак після проведення ряду експериментів було встановлено, що існують чинники, що визначають напрямок мимовільних реакцій.
У екзотермічних реакціях виділяється тепло нагріває реагенти, таким чином продовжуючи час протікання реакції, до того ж, нам відомо, що в екзотермічних реакціях енергія зменшується. Таким чином, хімічні реакції йдуть мимовільно в сторону зменшення енергії речовин.
Але багато реакції розкладання (ендотермічні за типом) теж можуть йти мимовільно, значить, зменшення енергії - не єдиний фактор.
[5]
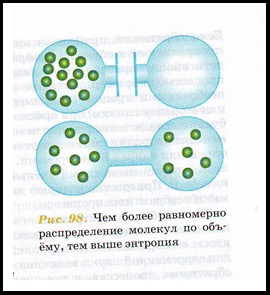
Ентропія (від грец. # 958; # 957; # 964; # 961; # 959; π # 943; # 945; - поворот, перетворення) - в природничих науках - міра безладу системи, що складається з багатьох елементів.
Ентропія позначається знаком S.
Рудольф Клаузіус вперше ввів це слово в термодинаміки в 1865 році. У термодинаміки воно означає міру незворотного розсіювання енергії, міру відхилення реального процесу від ідеального.
Чим рівномірніше розподіл всіх властивостей системи (енергії, тиску, температури і т. Д.), Тим більше ентропія. У напрямку збільшення ентропії і відбуваються всі самовільні процеси.
Тому другий початок термодинаміки в цілому формулюється так:
В ізольованих системах мимовільні процеси можуть протікати тільки зі збільшенням ентропії. При оборотних процесах ентропія не змінюється.
Третій закон термодинаміки: Теорема Нернста: Ентропія будь-якої системи при абсолютному нулі температури завжди може бути прийнята рівною нулю.
Існує також примітка до початків. або нульовий закон термодинаміки.
Нульовий початок термодинаміки говорить:
Для кожної ізольованою термодинамічної системи існує стан термодинамічної рівноваги, якого вона при фіксованих зовнішніх умовах з плином часу мимоволі досягає.
При розрахунках хімічних реакцій хімікам важливо знати ці закони.
Термодинаміка містить безліч формул, що описують перетворення енергії в ході хімічних реакцій, і всі вони підкоряються основним законам, мова про які йшла в цьому розділі.
Тепловий ефект.
Жодна хімічна реакція не проходить без витрат або виділення певної кількості енергії або тепла. Це відбувається тому, що в кожному речовині спочатку присутня деяка кількість енергії. Причому в різних речовинах ця кількість різний.
В ході реакції відбувається розрив зв'язків у вихідних речовинах і утворення нових зв'язків в продуктах реакції. Оскільки освіту зв'язку йде з виділенням, а її розрив - з поглинанням енергії, то хімічні реакції супроводжуються енергетичними ефектами.
На основі різниці між запасом енергії у вихідних речовинах і продуктах реакції виділяють два типи реакцій.
Перший тип - реакції з виділенням тепла, або екзотермічні (від грец. Екзо - назовні) реакції. До нього відносяться реакції, в яких запас енергії вихідних речовин більше, ніж запас енергії продуктів реакції. В такому випадку енергія виділяється в навколишнє середовище, тому потрібно організувати відведення тепла, щоб уникнути перегріву або вибуху хімічного реактора.
Реакції, в яких продукти мають більший запас енергії, ніж вихідні речовини, відносять до другого типу - реакції з поглинанням тепла, або ендотермічні (від грец. Ендо- - всередину). У ендотермічних реакціях необхідне тепло поглинається з навколишнього середовища, тому в лабораторіях такі реакції відбуваються при нагріванні.
Вперше терміни «екзотермічний» і «ендотермічний» ввів французький хімік Пьер Бертло [6]. вважається одним з основоположників термохімії [7].
Прикладом екзотермічніреакцій можуть служити реакції горіння. Наприклад, природний газ (метан CH4) згорає в кисні повітря з виділенням великої кількості теплоти:
Також до екзотермічним відносяться розчинення металів в кислотах, реакції нейтралізації і багато інших.
Прикладом ендотермічної реакції є утворення оксиду вуглецю (II) CO і водню H2 з вугілля та води, яке відбувається тільки при нагріванні:
Таким чином, будь-яка хімічна реакція супроводжується виділенням або поглинанням енергії. Найчастіше енергія виділяється або поглинається у вигляді теплоти (рідше - у вигляді світлової або механічної енергії). Цю теплоту можна виміряти. Результат вимірювання виражають в килоджоулях (кДж) для 1 моль реагенту або (рідше) для 1 моль продукту реакції. Така величина називається тепловим ефектом реакції.
Тепловий ефект - кількість теплоти, що виділилася або поглинене хімічної системою при протікання у ній хімічної реакції.
Тепловий ефект позначається символом Q. Його величина відповідає різниці між енергіями вихідного і кінцевого станів реакції.
У екзотермічних реакціях Q> 0.
У ендотермічних реакціях Q <0.
Ми називаємо це явище тепловим ефектом. хоча точніше було б говорити про енергетичну ефекті реакції.
Рівняння, що ілюструють перебіг хімічних реакцій з тепловим ефектом, називаються термохімічними. У цих рівняннях важливо враховувати агрегатні стани речовин, що беруть участь в реакції, і значення теплового ефекту в кДж.
Позначення агрегатного стану речовини має велике значення. Наприклад, в реакції згоряння водню спочатку утворюється вода у вигляді пари (газоподібний стан), при конденсації якого може виділитися ще деяку кількість енергії. Отже, для утворення води у вигляді рідини виміряний тепловий ефект реакції буде трохи більше, ніж для освіти тільки пара, оскільки при конденсації пари виділиться ще порція теплоти.
Використовується також окремий випадок теплового ефекту реакції - теплота згоряння. Із самої назви видно, що теплота згоряння служить для характеристики речовини, що застосовується в якості палива. Теплоту згоряння відносять до 1 моль речовини, що є паливом (відновлювачем в реакції окислення), наприклад:
де 1300 кДж - теплота згоряння ацетилену.
Якщо реакція оборотна і може протікати в протилежних напрямках, то теплоти прямої і зворотної реакцій будуть рівні за абсолютною величиною і протилежні за знаком.
Запасені в молекулах енергію (Е) можна відкласти на енергетичної шкалою. В цьому випадку тепловий ефект реакції (# 916; Е) можна показати графічно.