Глава 2. Розчини й дисперсні системи
П р и м і р 2.7. Який об'єм розчину хлороводню з масовою часткою 36% і щільністю 1,179 г / мл потрібно для отримання 250 мл розчину хлороводню з молярною концентрацією 0,1 моль / л?
Рішення За формулою (2.1), перетвореної щодо л (Х), знайдемо кількість речовини хлороводню, необхідного для приготування необхідного розчину:
л (НС1) = з (НС1) До розчину = 0,1 моль / л-0,25 л = 0,025 моль.
Масу, яка відповідає цієї кількості речовини, обчислимо за формулою (2.2), перетвореної щодо т (Х) '
/ Я (НС1) = «(НС1) Л / (НС1) = 0,025 моль 36,5 г / моль = 0,9125 м
Така ж маса хлороводню повинна утримуючи 1ься і в вихідному розчині. Масу цього розчину знайдемо за формулою (2.4), перетвореної відносна
_ Т (НС1) _ 0,9125 г _ _.
/ "Розчину, підсумок. _. ГТ7 4, JJ4 Г.
Шуканий обсяг розчину обчислимо за формулою
де р розчину - щільність розчину Підставами в цю формулу розраховане значення маси розчину і пліт-
ність розчину, зазначену в завданні
^ Розчину = 2,535 Г 1,179 Г / МЛ = 2,15 МЛ.
Розчинність твердих речовин і рідин характеризується за допомогою коефіцієнта розчинності, який показує, яка маса речовини може максимально розчинитися в 100 г розчинника. Коефіцієнт розчинності часто називають просто розчинність. Розчин, в якому при даній температурі речовина не може розчинятися, називається насиченим
П р и м і р 2.8. Коеффіціен г розчинності перманганату калію при 20 ° С дорівнює 6,4 г. Обчисліть масову частку перманганату калію в його насиченому розчині при цій температурі
Рішення. Припустимо, що маса розчиненого перманганату калію дорівнює 6,4 г Тоді, виходячи з визначення коефіцієнта розчинності, маса води дорівнює 100 г, а маса розчину - сумі розчиненої речовини і розчинника:
/ "Розчину = /" (КМПО 4) + / я (Н 2 О) = 6,4 г + 100 г = 106,4 м
2.3. Способи кількісного вираження складу розчину
Масова частка перманганату калію в насиченому розчині відповідно до формули (2.4) дорівнює:
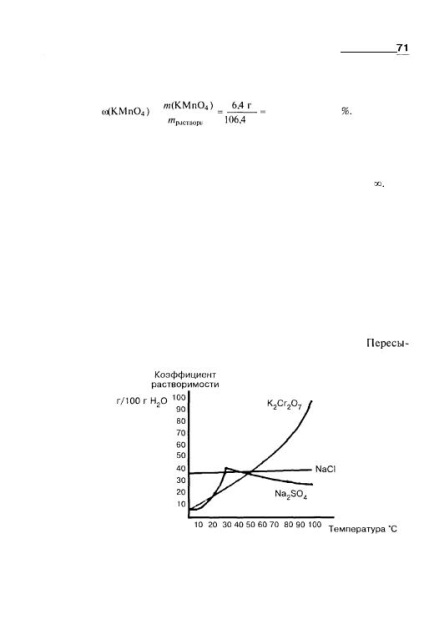
Деякі рідини змішуються в будь-яких співвідношеннях, наприклад у воді необмежено розчиняються етанол, гліцерин, оцтова кислота. Необмежена розчинення позначається символом оо. Розчинність обмежено розчиняються рідин збільшується, як правило, зі збільшенням температури. При досягненні певного значення розчинність може перейти в необмежену. Наприклад, при 16 ° С в 100 г води розчиняється 6,7 г фенолу, однак при температурі вище 66 ° С фенол змішується з водою в будь-якому співвідношенні. Розчинність твердих речовин також в основному збільшується зі збільшенням температури. На малюнку 2.3 представлений різний характер впливу температури на розчинність деяких солей. Якщо розчин, насичений при більш високій температурі, обережно охолодити, то можна отримати пересичений розчин, масова частка розчиненої речовини в якому більше масової частки, розрахованої з використанням коефіцієнта розчинності. Переси- Мал. 2.3. Залежність розчинності деяких солей від температури: розчинність дихромата калію різко збільшується зі збільшенням температури; розчинність хлориду натрію змінюється незначно, залишаючись практично незмінною; розчинність сульфату натрію спочатку збільшується, а потім зменшується.
Речовини з іонними або сільнополярних ковалентними зв'язками у водних розчинах піддаються електролітичноїдисоціації, в результаті чого утворюються протилежно заряджені іони - катіони і аніони. Катіони мають позитивний заряд і переміщаються в зовнішньому електричному полі до катода, аніони - негативний заряд, вони переміщаються до анода. Розчини, в яких містяться іони, здатні проводити електрику. Розплави іонних з'єднань також здатні проводити електрику. Розчини й розплави, містять іони, називають провідниками електрики другого роду (провідниками першого роду називають метали, в яких носіями електрики є електрони). Електролітами називають речовини, здатні до утворення провідників другого роду. Електролітами називають також і самі розчини і розплави, містять іони. Електролітами є практично все солі, кислоти і підстави. Теорію електролітичноїдисоціації запропонував в 1887 р шведський физикохимик С. Арреніус.
Речовини з слабополярная і неполярними ковалентними зв'язками, нездатні до електролітичноїдисоціації, називають неелектролітами. До них відносяться всі прості речовини, вуглеводні, деякі інші органічні речовини. Здатність молекулярних речовин до електролітичноїдисоціації характеризує не індивідуальна речовина, а систему - розчинена речовина + розчинник. Наприклад, етанол С 2 Н 5 ОН в воді - неелектроліт, а в середовищі рідкого аміаку - електроліт. Хлороводень у водному розчині - електроліт, а в бензольному розчині - неелектроліт. Оскільки найбільше значення в нашому житті мають водні розчини, в цьому розділі ми обмежимося лише розчинами, в яких розчинником є вода.
Електроліти, в свою чергу, діляться на сильні, середні і слабкі. Сильні електроліти здатні диссоциировать остачі: це означає, що речовина в розчині існує практично тільки в іонному вигляді. До сильних електролітів належать більшість речовин іонного складу, т. Е. Солей, а також деякі речовини молекулярної будови, наприклад НС1. Слабкі електроліти дисоціюють в незначній мірі, і переважною формою їх існування в розчині є молекулярна. Середні по силі електроліти дисоціюють таким чином, що концентрація іонів і молекул в їх розчинах порівнянна.
Глава 2. Розчини й дисперсні системи
Кількісно здатність молекулярного електроліту до дисоціації визначається ступенем іонізації (а):
де Л'общ - загальне число молекул, які перебували в розчині; N Hmm - число молекул, що розпалися на іони.
Ступінь іонізації висловлюють в частках одиниці або відсотках. Ступінь дисоціації 0,01 або 1% означає, що з 100 молекул розчиненої речовини тільки одна розпалася на іони. Як буде показано в розділі 9, ступінь дисоціації залежить від концентрації електроліту; вона збільшується в міру зменшення концентрації. Отже, порівнювати електроліти між собою за ступенем іонізації можна тільки при певній концентрації електроліту. Якщо ступінь іонізації електроліту в розчині з молярною концентрацією 0,1 моль / л більше 30%, то його вважають сильним, якщо менше 3% - слабким. Електроліти, для яких ступінь іонізації при цій концентрації знаходиться в проміжку, вважаються середніми.
Рівняння електролітичноїдисоціації записуються як рівняння звичайних реакцій, для сильних електролітів - з односторонньою стрілкою, для середніх і слабких - з двостороннім, наприклад:
П р и м і р 2.10. У воді об'ємом 500 мл розчинили 3,33 г кристалогідрату сульфату алюмінію, що кристалізується з 18 молекулами води. Обчисліть молярну концентрацію кожного іона в нинішньому розчині. Зміною обсягу при розчиненні знехтувати.
Рішення. Формульна одиниця цього кристаллогидрата - A1 2 (SO 4) 3 - 18H 2 O. Знайдемо його кількість речовини за формулою (2.2):
Кількість речовини сульфату алюмінію, при дисоціації "якого утворюються іони, дорівнює кількості речовини кристалогідрату:
«(A1 2 (SO 4) 3) = я (А1 2 (8О 4) 3 - 18Н 2 О) = 0,005 моль.
Запишемо рівняння електролітичноїдисоціації сульфату алюмінію, маючи на увазі, що ця речовина, як більшість солей, - сильний електроліт:
A1, (SO 4), -> 2А1 1+ + 3SO ^

2.4. Електролітична дисоціація
Як випливає з наведеного рівняння,
л (А1 3+) = 2л (А1 2 (8О 4) ,; / i (SO |
Після підстановки кількості речовини сульфату алюмінію отримуємо:
л (А1 3+) = 2-0,005 = 0,01 моль; л (5О ^
) = 3-0,005 = 0,015 моль.
Якщо скористатися формулою (2.1), то можна розрахувати молярні концентрації обох іонів в розчині:
П р и м і р 2.11. У певному обсязі розчину аміаку міститься 1,814 ммоль молекул аміаку і 0,186 ммоль іонів амонію. Обчисліть ступінь іонізації аміаку в цьому розчині.
Рішення. Запишемо рівняння електролітичноїдисоціації аміаку, беручи до уваги, що це слабкий електроліт:
N H 3 + H 2 O * ± №Ц + OFT.
Відповідно до наведеного рівнянням кількість речовини аміаку, яка зазнала іонізації (л іонш), дорівнює кількості речовини іонів амонію:
w (NH 3) m> H Hj = «(NHJ) = 0,186 ммоль.
Сумарна кількість речовини аміаку, який перебував в розчині, дорівнює сумі кількостей речовин аміаку, яка зазнала іонізації, і аміаку в молекулярній формі:
п (МН 3) заг = л (МН 3) іонш + «(NH 3) 40 ^ KW = 0,186 ммоль + 1,814 ммоль = 2 ммоль.
Відповідно до формули (2.6) ступінь іонізації аміаку в цьому розчині дорівнює:
а = nCNHaUHH. = ° - '86 ммоль = Q / J93 ^ 9> 3% «(NH3) of.iu 2 ммоль

Глава 2. Розчини й дисперсні системи
2.5. загальні уявлення
про дисперсних системах
Після попереднього знайомства з властивостями розчинів зупинимося коротко на деяких властивостях дисперсних систем. Гетерогенні дисперсні системи поділяються на високодисперсні системи (розмір часток в діапазоні від 10
7 м) і Грубодисперсні системи (розмір часток в діапазоні від 10
5 м). Сукупність роздроблених частинок в дисперсних системах називають дисперсною фазою, а середовище, в якій роздроблені частинки розподілені, - дисперсійним середовищем.
Прикладами грубодисперсних систем є суспензії і емульсії. У суспензіях частинки твердої речовини (дисперсної фази) дисперговані в рідкому дисперсійному середовищі. Дисперсна система, в якій частинки твердого сульфату кальцію розподілені у воді, - приклад суспензії. Така суспензія застосовується, наприклад, для штукатурки стін і виготовлення художніх виробів (алебастр), а також для виготовлення гіпсових пов'язок в медицині. Емульсія - тип грубодисперсной системи, в якій дрібні крапельки однієї рідини (дисперсна фаза) розподілені в рідкому дисперсійному середовищі. Класичний приклад емульсії - молоко, в якому крапельки жиру дисперговані у водному розчині солей і білків.
Високодисперсні системи, звані також колоїдно-дис- перснів системами, або золями, займають проміжне положення між істинними розчинами і грубодисперсними системами. Вони, наприклад, як і справжні розчини, проходять через звичайний фільтр, в той час як частки грубодисперсних систем таким фільтром затримуються. Колоїдно-дисперсні системи, так само як і Грубодисперсні системи, розшаровуються. Для колоїдно-дісперс- них систем характерна опалесценция, яка суб'єктивно оцінюється як проміжний стан між прозорим розчином і каламутній суспензією. Якщо розглядати золь, поміщений в лабораторну пробірку, збоку, т. Е. В світлі, створиться враження прозорості системи. Якщо ж розглядати той же золь у відбитому світлі, т. Е. Дивитися в пробірку зверху вниз, створиться враження каламутності системи. Якщо на золь направити тонкий пучок світла, то можна побачити слід проходження світла в золі у вигляді світиться конуса (конус Тиндаля) (рис. 2.4).
Колоїдно-дисперсні системи відіграють величезну роль в житті людини. Практично всі тканини рослинних і тваринних організ-
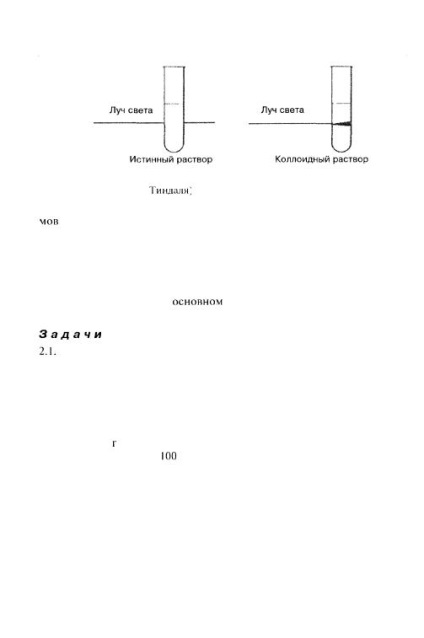
Мал. 2.4. При проходженні пучка світла через колоїдний розчин видно світиться конус (конус Тиндаля)
мов є колоїдно-дисперсні системи. До них відносяться деякі лікарські засоби, багато продуктів харчування, а також матеріали, що використовуються в промисловості і в побуті.
Дисперсні системи, в яких дисперсійним середовищем є газ, називаються аерозолями. Дим, туман, смог - приклади аерозолів.
Властивості розчинів (див. Розділ 9) і дисперсних систем (див. Розділ 20) докладно розбираються в основному курсі.
2.1. Етанол масою 90 г розчинили в 410 г води. Обчисліть масову частку спирту в отриманому розчині.
2.2. Обчисліть масу гідроксиду натрію, що міститься в 1,2 кг 7,5% розчину.
2.3. Обчисліть масу води, що міститься в 170 г 10% розчину хлориду калію.
2.4. Обчисліть масу 19% розчину нітрату калію, в якому міститься 95 г цієї солі.
2.5. До розчину масою 100 г з масовою часткою сірчаної кислоти 24% додали 300 г води. Обчисліть масову частку кислоти в новому розчині.
2.6. До розчину масою 200 г з масовою часткою гідроксиду калію 25% додали 50 г цієї ж лугу. Обчисліть масову частку лугу в новому розчині.
2.7. З розчину масою 500 г з масовою часткою нітрату літію 4% випарили 300 г води. Обчисліть масову частку солі в новому розчині.
2.8. З розчину масою 250 г з масовою часткою хлориду магнію 40% викристалізувалося 50 г цієї солі. Обчисліть масову частку солі в новому розчині.

Глава 2. Розчини й дисперсні системи
2.9. Сірчану кислоту масою 14,7 г розчинили у воді і об'єм розчину довели до 200 мл. Обчисліть молярну концентрацію кислоти в розчині.
2.10. Яка маса дихромата калію потрібно для приготування розчину об'ємом 0,75 л з молярною концентрацією 0,2 моль / л?
2.11. В якому обсязі розчину з молярною концентрацією хлориду барію 0,12 моль / л міститься 6,24 г цієї солі?
2.12. Сульфат амонію масою 45 г розчинили в 180 г води, при цьому вийшов розчин з щільністю 1,115 г / мл. Обчисліть масову концентрацію солі в розчині.
2.13. Обчисліть, яку масу розчину солі з масовою часткою 5% слід взяти для приготування 100 г розчину тієї ж солі з масовою часткою, що дорівнює 2%.
2.14. Обчисліть, яку масу розчину солі з масовою часткою 10%
слід взяти для приготування 1 кг розчину тієї ж солі з масовою часткою, що дорівнює 8%.
2.15. Обчисліть, яку масу води слід додати до 0,5 кг розчину солі з масовою часткою 20%, щоб отримати розчин тієї ж солі
з масовою часткою, що дорівнює 15%.
2.16. Обчисліть, яку масу води слід додати до розчину солі з масовою часткою 20%, щоб отримати 0,5 кг розчину тієї ж солі
з масовою часткою, що дорівнює 15%.
2.17. Розрахуйте молярну концентрацію розчину хлориду жслеза (П) з масовою часткою, що дорівнює 10% (пл. 1,092 г / мл).
2.18. Розрахуйте молярну концентрацію розчину сульфату міді з масовою часткою, що дорівнює 0,12 (пл. 1,131 г / мл).
2.19. Розрахуйте молярну концентрацію розчину нітрату хрому (Ш) з масовою часткою, що дорівнює 16% (пл. 1,141 г / мл).
2.20. Розрахуйте молярну концентрацію розчину броміду кобальту (П) з масовою часткою, що дорівнює 0,18 (пл. 1,182 г / мл).
2.21. Розрахуйте масову частку азотної кислоти в розчині з молярною концентрацією, що дорівнює 6,273 моль / л (пл. 1,200 г / мл).
2.22. Розрахуйте масову частку сірчаної кислоти в розчині з молярною концентрацією, що дорівнює 0,1783 моль / л (пл. 1,010 г / мл).
2.23. Розрахуйте масову частку хлороводню в розчині з молярною концентрацією, що дорівнює 1,20 моль / л (пл. 1,025 г / мл).
2.24. Розрахуйте масову частку фосфорної кислоти в розчині з молярною концентрацією, що дорівнює 1,510 моль / л (пл. 1,075 г / мл).
2.25. Розрахуйте, який обсяг розчину хлориду алюмінію з масовою часткою 0,16 (пл. 1,149 г / мл) потрібно для приготування 500 мл розчину з молярною концентрацією, що дорівнює 0,1 моль / л.
