частинки (молекули, атома, іона), мінімальна різниця потенціалів U, к-рую повинен пройти електрон в ускоряющем електричні. поле, щоб придбати кинетич. енергію, достатню для іонізації частинки. П. і. частинки X з утворенням частки X 'відповідає процесу:
Більш загальне поняття-енергія іонізації Е, мінім. енергія, необхідна для видалення електрона з частки на нескінченність. Вона пов'язана з П. і. співвідношенням:
де е елементарний електричні. заряд. Енергія іонізації є св-вом частки і не залежить від способу видалення електрона, тоді як П. і. строго кажучи, лише характеристика історично першого методу іонізації електронним ударом (див. Іони в газах) .Енергія іонізації, виражена в еВ, чисельно збігається з П. і. вираженим в В.
Розрізняють перший, другий і т. Д. П. і. відповідні видалення з частки першого, другого і т. д. електронів. Другий П. і. нейтральної частинки X збігається з першим П. і. іона Х + і т. д. Перший П. і. отрицат. іона Х - збігається зі спорідненістю до електрону частинки X.
Для атомів поняття першого, другого і т. Д. П. і. відносять до іонізації збудженого атома з утворенням збудженого покладе. і вона. Для молекул розрізняють адіабатичний П. і. і вертикальні П. і. Адіабатичний П. і. відповідає процесу, при к-ром з молекули, що знаходиться в основному стані, в результаті іонізації утворюється покладе. мовляв. іон також в основному стані. Вертикальні П. і. характеризують іонізацію молекул, при якій утворюється мовляв. іон може Розміщена в довільному енергетичних. стані (електронному та коливальному), причому відповідні квантові переходи відбуваються без зміни меж'ядерних відстаней (рис. 1).
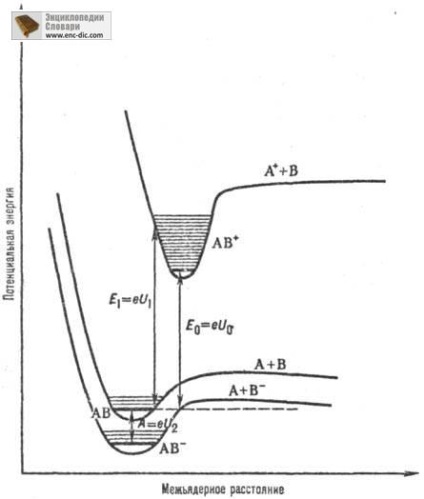
Мал. 1. Криві потенц. енергії для основних електронних станів молекули АВ і іонів АВ + і АВ -. U0 - перший АДІАБАТА, потенціал іонізації молекули АВ (E0-енергія іонізації); U1- перший вертикальний потенціал іонізації молекули АВ (Е 1 відповідна енергія іонізації), A-Адіабени-тич. спорідненість до електрону молекули АВ (U2 -адіабатіч. потенціал іонізації іона АВ -).
Можливо термодинамич. визначення П. і. атомів і адіабатичного П. і. молекул через стандартну ентальпію DH 0 р-ції XХ + + е при абс. нулі т-ри:
де NA-постійна Авогадро.
Перші П. і. відомі для атомів всіх елементів перио-дич. системи і нсск. тис. молекул. У легких атомів з зарядом ядра Z <10-15, как правило, надежно определены все П. и. (первый, второй и т. д. до Z); у более тяжелых атомов-неск. начальных П. и. В изменении первых П. и. атомов явно выражена периодичность при увеличении Z. При движении слева направо по периоду П. и. вообще говоря, постепенно увеличивается; при увеличении Z в пределах подгруппы П. и. уменьшается (рис. 2).
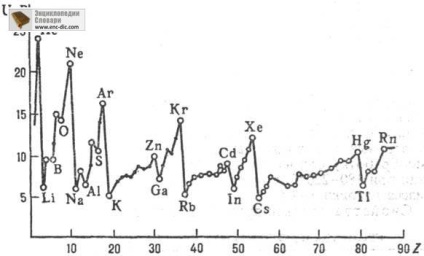
Мал. 2. Залежність перших потенціалів іонізації U1 атомів хім. елементів від атомного номера Z.
Осн. суч. методи визначення П. і. фотоелектронна спектроскопія, фотоионизация, вивчення іонно-молекулярних реакцій, поверхнева іонізація. Найкраща точність визначення П. і. атомів і найпростіших молекул досягається при використанні спектроскопіч. даних по збіжності серій спектральних ліній. Для складних молекул краще фотоелектронна спектроскопія (досягається точність до b0,001 еВ). Слід, однак, мати на увазі, що цей метод в загальному випадку дає значення вертикальних, а не адіабатичного П. і. На П. і. атомів і атомних іонів впливає, крім Z, екранує ефект нижчих електронних рівнів. Мінімальні перші П. і. мають лужні метали: Cs 2,893 В, Li 5,390 В; максимальні - благородні гази: Чи не 24,580 В, Rn 10,745 В. Відомі П. і. молекул-це величини від 5 до 20 В (див. табл.).
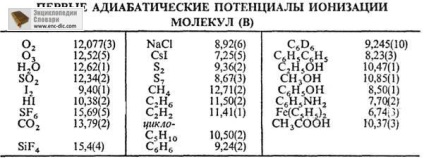
В кін. 70-х рр. 20 в. виявлені т. зв. суперщелочі-молекули з екстремально низькими значеннями П. і. ОК 4 (3,62 В), ОК 3 (3,65 В), ClNa2 (4,15 В) і ін.
При переході від валентних електронів атома до остовне П. і. різко збільшується. Так, для Be U1 9,320 В,