Отримання аміаку. Проведемо всі дії, описані в підручнику.
Зберіть прилад, як показано на малюнку 50.
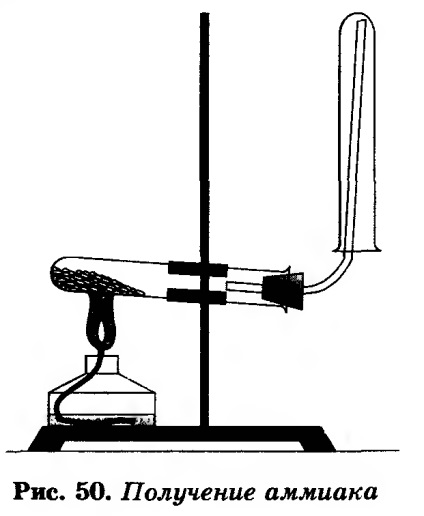
На аркуш паперу або в невелику порцелянову чашку (можна ступку) насипте хлорид амонію і гідроксид кальцію об'ємом по одній ложечці (ложечка для спалювання речовин).
Суміш перемішайте скляною паличкою і висипте в суху пробірку. Закрийте її пробкою з газовідвідною трубкою і зміцните в лапці штатива.
При зміцненні приладу в лапці штатива зверніть увагу на нахил пробірки щодо її отвори. На газовідвідну трубку надіньте суху пробірку для збирання аміаку.
Пробірку з сумішшю хлориду амонію і гідроксиду кальцію прогрійте спочатку всю (2-3 дви
вання полум'я), а потім нагрійте в тому місці, де знаходиться суміш. Для виявлення аміаку піднесіть до отвору перевернутої догори дном пробірки вологу фенолфталеїнової папірець. Виявивши аміак, піднесіть до отвору пробірки скляну паличку, змочену концентрованою соляною кислотою. Що ви спостерігаєте? Напишіть рівняння реакції.
Припиніть нагрівання суміші. Пробірку, в якій зібрано аміак, обережно зніміть з газовідвідної трубки, тримаючи її догори дном (кінець газовідвідної трубки відразу ж після зняття з неї пробірки з аміаком закрийте шматочком мокрій вати).
Негайно закрийте отвір знятої пробірки великим пальцем і опустіть в посудину з водою. Палець відніміть тільки під водою. Що ви спостерігаєте? Чому вода піднялася в пробірці? Знову закрийте пальцем отвір пробірки під водою і вийміть її з посудини.
1. Чому в даному випадку пробірку з сумішшю речовин потрібно зміцнювати в лапці штатива так, щоб її дно було трохи вище відкритого кінця? Запис рівняння реакції між хлоридом амонію і гідроксидом кальцію допоможе вам відповісти на питання.
2. Чому аміак збирають в перевернуту догори дном пробірку? Які ще гази можна збирати таким способом?
3. Що можна спостерігати, якщо замість соляної кислоти піднести до отвору пробірки з аміаком паличку, змочену концентрованою азотною кислотою? Напишіть рівняння реакції.
4. Як довести, що у водному розчині аміаку містяться гідроксид-іони?
Вивчення властивостей водного розчину аміаку
1. У пробірку налийте 2-3 мл водного розчину аміаку і додайте 2-3 краплі розчину фенолфталеїну. Який колір розчину? Нагрійте цей розчин до кипіння. Як зміниться забарвлення розчину? Чим викликано це зміна?
2. Налийте в пробірку 2-3 мл водного розчину аміаку. Додайте 2-3 краплі розчину фенолфталеїну і доливають по краплях розчин соляної кислоти до зникнення малинового забарвлення. Чому зникла забарвлення? Напишіть іонні рівняння реакції (повне та скорочене).
3. У пробірку налийте 2-3 мл водного розчину хлориду алюмінію і додайте ще стільки ж водного розчину аміаку. Що ви спостерігаєте? Напишіть іонні рівняння реакції (повне та скорочене).


Вивчення властивостей водного розчину аміаку.
