Хімічна зв'язок -це сила, що утримує разом два або кілька атомів, іонів, молекул або будь-яку комбінацію з них. За своєю природою вона являє собою електростатичну силу тяжіння між негативно зарядженими електронами і позитивно зарядженими ядрами. Величина цієї сили тяжіння залежить головним чином від електронної конфігурації зовнішньої оболонки атомів (див. Гл. 1). Наприклад, благородні гази з працею утворюють хімічні зв'язки, тому що вони мають стійку зовнішню електронну оболонку. На відміну від цього елементи, атоми яких мають у зовнішній оболонці тільки один електрон, легко утворюють зв'язку. Прикладом таких елементів є водень.
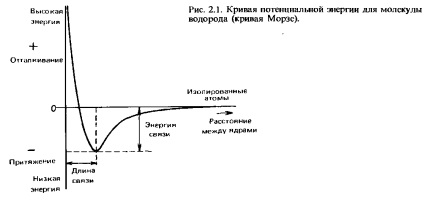
Коли два атоми водню зближуються на малу відстань, вони притягуються один до одного. Однак, якщо вони зближуються занадто сильно, між ними виникає відштовхування. Оптимальним виявляється таку відстань, при якому сили тяжіння і відштовхування врівноважуються. Ha такій відстані потенційна енергія двох взаємодіючих атомів мінімальна. Ця відстань називається довжиною зв'язку. Ми ще повернемося до її більш докладного обговорення в цьому розділі. Ha рис. 2.1 показана залежність потенційної енергії від відстані між ядрами. Крива такого типу називається кривою Морзе. Енергія, необхідна для того, щоб розділити два пов'язаних між собою атома і видалити їх один від одного на відстань, на якому вони вже не відчувають сили тяжіння один до одного, називається енергія зв'язку, або енергія дисоціації зв'язку. Її експериментальне визначення здійснюється шляхом вимірювання ентальпії зв'язку (з цим поняттям ми познайомимося в гл. 5).
Здатність атома утворювати хімічні зв'язки називається його валентністю. Втім, це поняття вважається сильно застарілим, оскільки в даний час набагато частіше прийнято розглядати хімічний зв'язок не взагалі, а з урахуванням її конкретного типу. Електрони, пршшмающіе участь в утворенні хімічних зв'язків, називаються валентними електронами. Ці електрони перебувають на найвищих по енергії орбиталях атома (див. Гл. 1). Зовнішня оболонка атома, яка містить ці орбіталі, називається валентної оболонкою.
Електронна теорія валентності.Современние уявлення про природу хімічного зв'язку засновані на електронній теорії валентності. Цю теорію розробили незалежно Г. Н. Льюїс і В. Коссель в 1916 р Згідно електронної теорії валентності, атоми, утворюючи зв'язку, наближаються до досягнення найбільш стійкою (тобто має найбільш низьку енергію) електронної конфігурації. Атоми можуть досягти цього двома способами:
1. Вони можуть втрачати або здобувати електрони, утворюючи іони. Якщо атоми набувають електрони, вони перетворюються в аніони. Якщо вони втрачають електрони, то перетворюються в катіони. Аніони і катіони із заповненою зовнішньої електронної оболонкою мають стійку електронну конфігурацію. Між аніоном і катіоном виникає хімічний зв'язок, що представляє собою електростатичну силу тяжіння. Хімічна зв'язок такого типу раніше називалася електровалентной зв'язком; сучасну назву іонна зв'язок.
2. Атоми можуть також купувати стійкі зовнішні електронні конфігурації шляхом усуспільнення електронів. Виникає при цьому хімічний зв'язок називається ковалентним зв'язком. Ковалентний зв'язок утворюється в результаті усуспільнення пари електронів, що поставляються по одному від кожного атома. Однак в деяких молекулах або багатоатомних іони обидва таких електрона можуть поставлятися тільки одним атомом. Такий різновид ковалентного зв'язку називається координаційної, донорно-акцепторної або датівная ковалентним зв'язком.
Правило октету. Коли атом будь-якого елемента утворює хімічний зв'язок, набуваючи, втрачаючи або обобществляя валентні електрони, його електронна конфігурація стає такою ж, як у атома благородного газу, розташованого в кінці того ж періоду, що й цей елемент, або в кінці попереднього періоду. Атоми всіх благородних газів, за винятком гелію, мають у зовнішній оболонці стійкий октет (вісімку) електронів. Тому утворення хімічних зв'язків шляхом досягнення стійких електронних конфігурацій, як в атомах інертних газів, складає суть так званого правила октету. Це правило може бути застосовано і до іонним, і до нековалентним зв'язків.
Інші типи хімічного зв'язку. Особливий випадок являє собою хімічний зв'язок в металах; її не можна віднести ні до іонного типу, ні до ковалентному. У твердому стані метали складаються з позитивно заряджених іонів, щільно упакованих в кристалічну решітку і утримуваних разом вільними електронами, які «плавають» навколо іонів в «електронному море». Такий тип зв'язку називається металевим зв'язком.
Існують ще два типи хімічного зв'язку, які теж будуть розглядатися в цьому розділі. Це - воднева зв'язок і вандерваальсови сили. Зв'язки цих двох типів значно слабкіше, ніж зв'язку інших типів.