Енергетичний гомеостаз забезпечує енергетичні потреби тканин з використанням різних субстратів. Оскільки вуглеводи є основним джерелом енергії для багатьох тканин і єдиним для анаеробних, регуляція вуглеводного обміну є важливою складовою енергетичного гомеостазу організму.
Регуляція вуглеводного обміну здійснюється на 3 рівнях:
1. Центральний рівень регуляції вуглеводного обміну
Центральний рівень регуляції здійснюється за участю нейроендокринної системи і регулює гомеостаз глюкози в крові і інтенсивність метаболізму вуглеводів в тканинах. До основних гормонів, що підтримують нормальний рівень глюкози в крові 3,3-5,5 ммоль / л, відносять інсулін і глюкагон. На рівень глюкози впливають також гормони адаптації - адреналін, глюкокортикоїди і інші гормони: тиреоїдні, СДГ, АКТГ і т.д.
2. межорганную рівень регуляції вуглеводного обміну
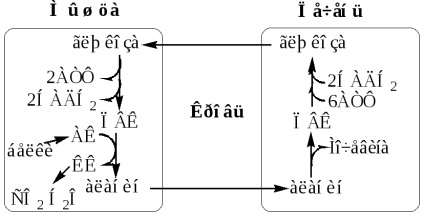
Глюкозо-лактатний цикл (цикл Корі) Глюкозо-аланіновий цикл
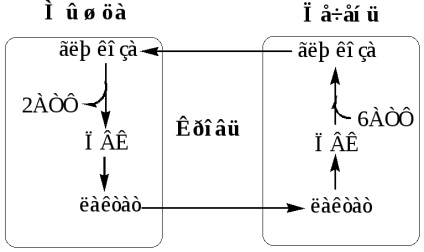
Глюкозо-лактатний цикл не вимагає наявність кисню, функціонує завжди, забезпечує: 1) утилізацію лактату, що утворюється в анаеробних умовах (скелетні м'язи, еритроцити), що запобігає лактоацидоз; 2) синтез глюкози (печінка).
Глюкозо-аланіновий цикл функціонує в м'язах при голодуванні. При дефіциті глюкози, АТФ синтезується за рахунок розпад білків і катаболізму амінокислот в аеробних умовах, при цьому глюкозо-аланіновий цикл забезпечує: 1) видалення азоту з м'язів в нетоксичного формі; 2) синтез глюкози (печінка).
3. Клітинний (метаболічний) рівень регуляції вуглеводного обміну
Метаболічний рівень регуляції вуглеводного обміну здійснюється за участю метаболітів і підтримує гомеостаз вуглеводів всередині клітини. Надлишок субстратів стимулює їх використання, а продукти інгібують свою освіту. Наприклад, надлишок глюкози стимулює глікогенез, липогенез і синтез амінокислот, дефіцит глюкози - глюконеогенез. Дефіцит АТФ стимулює катаболізм глюкози, а надлишок - навпаки пригнічує.
IV. Педфак. Вікові особливості ПФШ і ГНГ, значення.
Лекція № 10 Тема: Структура і обмін інсуліну, його рецепторів, транспорт глюкози. Механізм дії і метаболічні ефекти інсуліну.
Гормони підшлункової залози
Підшлункова залоза виконує в орга-низме дві найважливіші функції: екзокринну і ендокринну. Екзокринну функцію виконує ацинарна частина підшлункової залози, вона синтезує і секретує панкреатичний сік. Ендокринну функцію виконують клітини острівковогоапарату підшлункової залози, які секретують пептидні гормони, навчаючи-ствующие в регуляції багатьох процесів в організме.1-2 млн. Острівців Лангерганса становлять 1-2% маси підшлункової залози.
У островковой частини підшлункової залози виділяють 4 типи клітин, які секретують різні гормони: А- (або α-) клітини (25%) секретують глюкагон, В- (або β-) клітини (70%) - інсулін, D- (або δ- ) клітини (<5%) — соматостатин, F-клетки (следовые количества) секретируют панкреатический полипептид. Глюкагон и инсулин в основном влияют на углеводный обмен, соматостатин локально регулирует секрецию инсулина и глюкагона, панкреатический полипептид влияет на секрецию пищеварительных соков. Гормоны поджелудочной железы выделяются в панкреатическую вену, которая впадает в воротную. Это имеет большое значение т.к. печень является главной мишенью глюкагона и инсулина.
Інсулін - поліпептид, що складається з двох ланцюгів. Ланцюг А містить 21 ами-нокіслотний залишок, ланцюг В - 30 амінокислотних залишків. В інсуліні 3 дисульфідних містка, 2 з'єднують ланцюг А і В, 1 з'єднує 6 і 11 залишки в А ланцюга.
Інсулін може існувати у формі: мономера, димера і гексамерів. Гексамерная структура інсуліну стабілізується-ється іонами цинку, який зв'язується залишками Гіс в положенні 10 В-ланцюга всіх 6 субодиниць.
Інсуліни деяких тварин мають значну схожість з первинної структурі з інсуліном людини. Бичачий інсулін відрізняється від інсуліну людино на 3 амінокислоти, а інсулін свині відрізняється тільки на 1 ами-нокіслоту (ала замість тре на С кінці В-ланцюга).
У багатьох положеннях А і В ланцюга зустрів чаются заміни, що не роблять впливу на біологічну активність гормону. У положеннях дисульфідних зв'язків, залишків гідрофобних амінокислот в С-кінцевих ділянках В-ланцюга і С- і N-кінцевих залишків А-ланцюга заміни зустрічаються дуже рідко, тому що ці ділянки забезпечують формування активного центру інсуліну.
Біосинтез інсуліну включає освіту двох неактивних попередників, препроінсуліну і проінсуліну, які в результаті послідовно-ного протеолізу перетворюються в активний гормон.
1. На рибосомах ЕПР синтезується препроинсулин (L-В-С-А, 110 амінокислот), біосинтез його починається з освіти гидрофобного сигнального пептиду L (24 амінокислот), який направляє зростаючу ланцюг в просвіт ЕПР.
2. У просвіт ЕПР препроинсулин перетворюється в проінсулін при відщепленні ендопептідазу I сиг-нального пептиду. Цистеїну в проінсуліну окислюються з утворенням 3 дисульфідних містків, проінсулін ставати «складним», має 5% активності від інсуліну.
3. «Складний» проінсулін (В-С-А, 86 амінокислот) надходить в апарат Гольджі, де під действи-му ендопептідази II розщеплюється з утворенням інсуліну (В-А, 51 амінокислот) і С-пептиду (31 амінокислота).
5. Зрілі гранули слі-ються з мембраною, а инсу-лін і С-пептид потрапляють в позаклітинне рідина і далі в кров. У крові олігомери інсуліну розпадається-ся. За добу в кров секретується 40-50 од. інсуліну, це становить 20% від його загального запасу в підшлунковій залозі. Секреція інсуліну енергозалежний процес, відбувається за участю мікротубулярної-ворсинчатой системи.
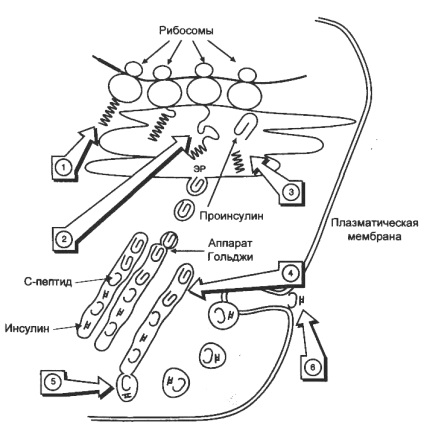
Схема біосинтезу інсуліну в β-клітинах острівців Лангерганса
ЕПР - ендоплазматичнийретикулум. 1 - освіту сигнального пептиду; 2 - синтез препроінсуліну; 3 - відщеплення сигнального пептиду; 4 - транспорт проінсу-лина в апарат Гольджі; 5 - перетворення проінсуліну в інсулін і С-пептид і включення інсуліну і С-пептиду в секреторні гранули; 6 - секреція інсуліну і С-пептиду.
Ген інсуліну перебувати в 11 хромосомі. Виявлено 3 мутації цього гена, у носіїв низька активність інсуліну, відзначається гіперінсулінемія, немає інсулінорезистентності.
Регуляція синтезу і секреції інсуліну
Синтез інсуліну індукують глюкоза і секреція інсуліну. Репресує секрецію жирні кислоти.
Секрецію інсуліну стимулюють: 1. глюкоза (головний регулятор), амінокислоти (особливо лей і арг); 2. гормони шлунково-кишкового тракту (β-адренергічні агоністи, через цАМФ): ГІП. секретин, холецистокінін, гастрин, ентероглюкагон; 3. тривало високі концентрації СТГ, кортизолу, естрогенів, дидрогестерон, плацентарного лактогену, ТТГ, АКТГ; 4. глюкагон; 5. підвищення К + або Са 2+ в крові; 6. ліки, похідні сульфонілсечовини (глібенкламід).
Під впливом соматостатину секреція інсуліну знижується. β-клітини також знаходяться під впливом автономної нервової системи. Парасимпатична частина (холінергічні закінчення блукаючого нерва) стимулює виділення інсуліну. Симпатична частина (адреналін через α2-адренорецептори) пригнічує виділення інсуліну.
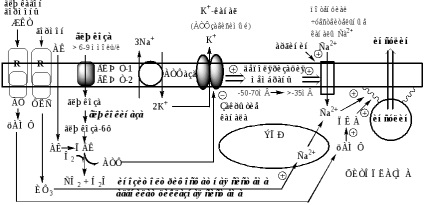
Секреція інсуліну здійснюється за участю кількох систем, в яких основна роль належить Са 2+ і цАМФ.
Надходження Са2 + в цитоплазму контролюється кількома механізмами:
1). При підвищенні концентрації глюкози в крові вище 6-9 ммоль / л, вона за участю ГЛЮТ-1 і ГЛЮТ-2 надходить в β-клітини і фосфорилюється глюкокіназа. При цьому концентрація глюкозо-6ф в клітці прямо пропорційна концентрації глюкози в крові. Глюкозо-6ф окислюється з утворенням АТФ. АТФ утворюється також при окисленні амінокислот і жирних кислот. Чим більше в β-клітині глюкози, амінокислот, жирних кислот тим більше з них утворюється АТФ. АТФ пригнічує на мембрані АТФ-залежні калієві канали, калій накопичується в цитоплазмі і викликає деполяризацію клітинної мембрани, що стимулює відкриття потенціалзалежні Са 2+ -каналів і надходження Са 2+ в цитоплазму.
2). Гормони, що активують інозітолтріфосфатную систему (ТТГ), випускають Са 2+ з мітохондрій і ЕПР.
цАМФ утворюється з АТФ за участю АЦ, яка активується гормонами шлунково-кишкового тракту, ТТГ, АКТГ, глюкагоном і Са 2+ -кальмодуліновим комплексом.
цАМФ і Са 2+ стимулюють полімеризацію субодиниць в мікротубули (мікроканальци). Вплив цАМФ на мікроканальцевую систему опосередковується через фосфорилювання ПК А мікроканальцевих білків. Мікроканальци здатні скорочуватися і розслаблятися, переміщаючи гранули у напрямку до плазматичної мембрані забезпечуючи екзоцитоз.
Секреція інсуліну у відповідь на стимуляцію глюкозою є двухфазную реакцію, що складається з стадії швидкого, раннього вивільнення інсуліну, звану першою фазою секреції (починається через 1 хв, триває 5-10 хв), і другої фази (тривалість її до 25-30 хв) .
Транспорт інсуліну. Інсулін водорастворим і не має білка-переносника в плазмі. Т1 / 2 інсуліну в плазмі крові становить 3-10 хв, С-пептиду - близько 30 хв, проінсуліну 20-23 хв.
Руйнування інсуліну відбувається під дей-наслідком інсулінозалежній протеїнази і глутатіон-інсулін-трансгідрогенази в тканинах мішенях: в основному в пе-чені (за 1 прохід через печінку руйнується близько 50% інсуліну), в меншій мірі в нирках і плаценті.