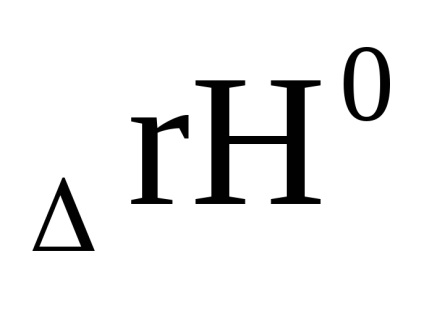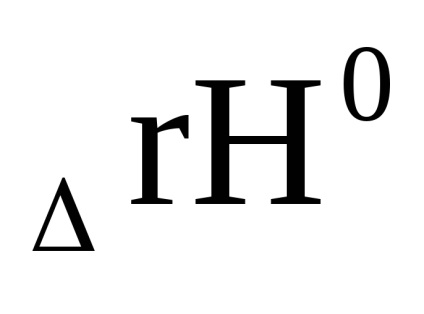0 + RT lnpi в
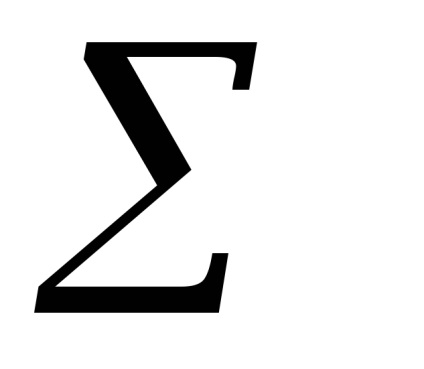

(Парціальні тиску відносяться до нерівноважному станом)
Сума в першій скобці, як показано при виводі рівняння (1.84) за умови Δ G = 0, дорівнює -RT lnКp. Отже, Δr G = -RT lnКp + RT (ср'С + dр'D - ар'А - bр'В) або
Δr G = RT (ln
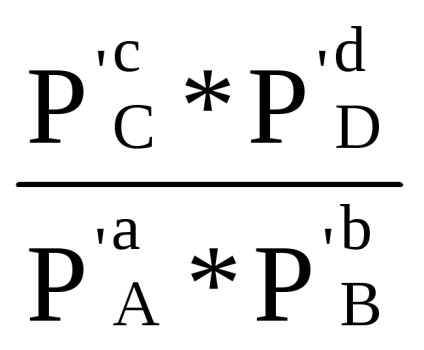
Отримане рівняння називається рівнянням ізотерми хімічної реакції (або рівнянням Вант-Гоффа, 1886 г.), воно пов'язує енергію Гіббса реакції з константою хімічної рівноваги і початковим парціальним тиском реагуючих речовин.
Якщо парціальний тиск всіх ділянок реакції у вихідній суміші дорівнюють одиниці (р i = 1), то з рівняння (1.87) випливає, що
Δr G 0 = -RT ln Кр (1.88)
Величина Δr G 0 - стандартний ізобарно-ізотермічний потенціал реакції при обраній температурі - Т. Після заміни -RTlnКр наΔr G 0 рівняння (1.87) приймає наступний вигляд:
Δr G = Δr G 0 + RT ln
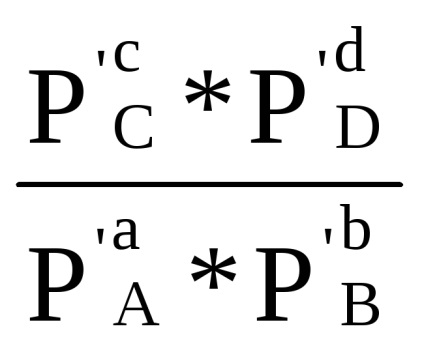
З рівняння видно, що зміна ізобарно-ізотермічного потенціалу реакції складається з двох частин. Одна частина Δr G 0 - зміна для гіпотетичної реакції, в якій все реагують речовини взяті в стандартному стані. Для даної реакцііΔr G 0 - постійна величина при р, Т, що залежить тільки від природи учасників реакції. Другий член в рівнянні (1.89) відображає завісімостьΔr G 0 від складу реакційної ланцюга.
Він являє собою збільшення ізобарно-ізотермічного потенціалу, яке виходить при переході реагуючих речовин, взятих при будь-яких парціальних тисках (концентраціях) в продукти реакції, так само взятих при будь-яких парціальних тисках.
Залежність константи рівноваги від температури. Рівняння ізобари реакції.
Хімічна рівновага є динамічним, воно зміщується в ту чи іншу сторону при зміні зовнішніх умов. Зокрема, на положення рівноваги, і, отже, на константу рівноваги впливає температура.
Функціональну залежність константи рівноваги від температури при постійному тиску можна отримати виходячи з рівняння ізотерми реакції (1.87) і рівняння Гіббса - Гельмгольца (1.70).
Продифференцируем рівняння ізотерми реакції (1.87) по температурі з урахуванням, що р'А. Р'В. р'С. р'D задані і від температури не залежить, отримаємо
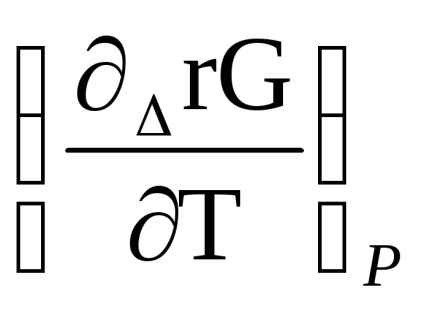
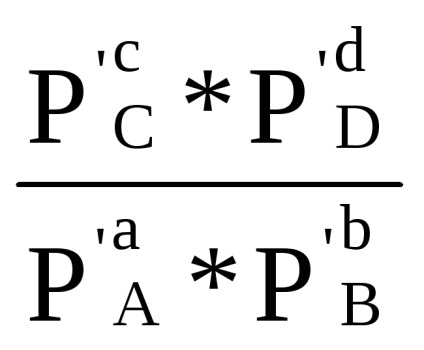
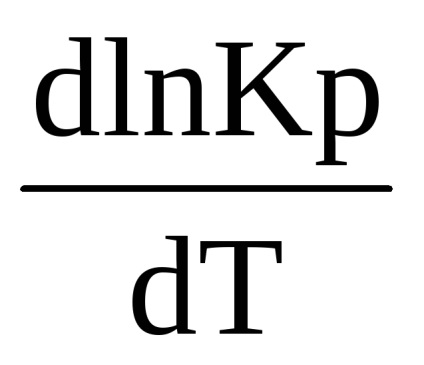
Підставами в рівняння Гіббса - Гельмгольца:
Δr G (т) = Δr Н (т) + Т [
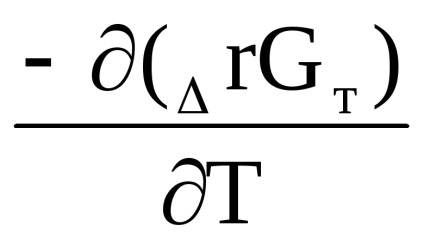
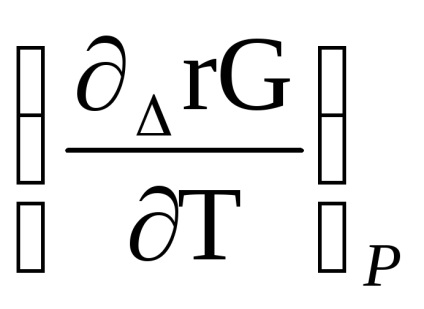
RТln
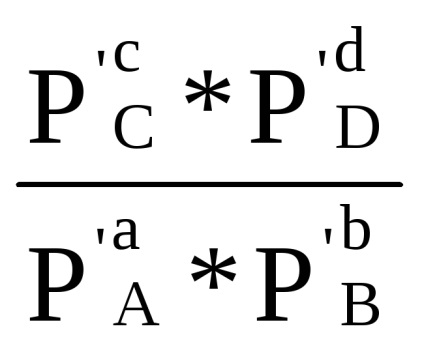
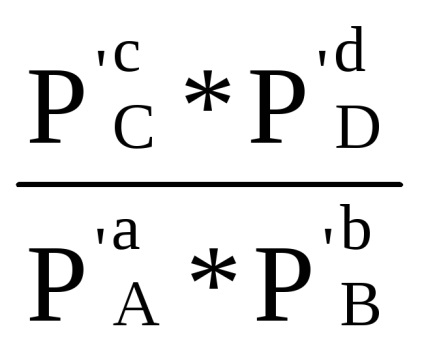
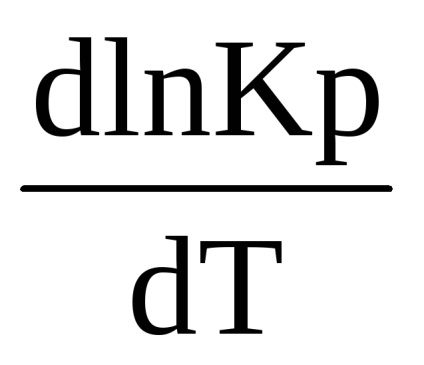
Після скорочення отримаємо:
Це рівняння встановлює зв'язок між зміною константи рівноваги з температурою і тепловим ефектом реакції. Воно відноситься до процесів, що відбувається при постійному тиску і називається рівнянням ізобари (Вант-Гоффа, 1885 г.)
Для розрахунків рівноваги при різних температурах рівняння (1.90) необхідно проінтегрувати. Після розділення змінних маємо
У вузькому інтервалі температур тепловий ефект реакції практично не залежить від температури, тобто Δ Ср = 0. Тому, після інтегрування отримаємо
де В - постійна інтегрування.
З порівняння рівняння (1.91) з рівнянням (1.88а) видно, що В =
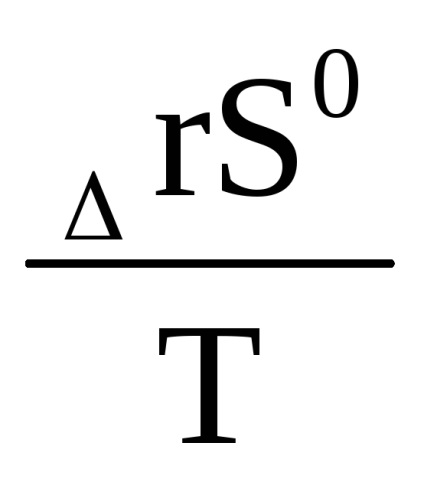
Рівняння (1.91) віднесене до стандартних умов можна записати у вигляді:
де
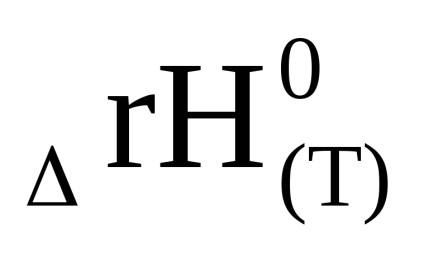
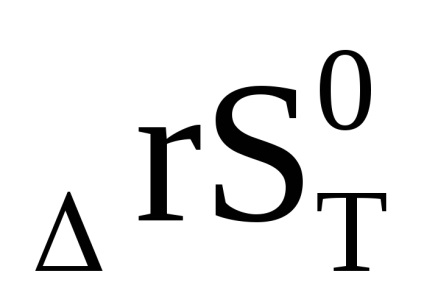
З рівняння (1.92) випливає, що ln Кр, а, отже, і константа рівноваги може при підвищенні температури і збільшуватися і зменшуватися. Це пов'язано зі знаком зміни ентальпії
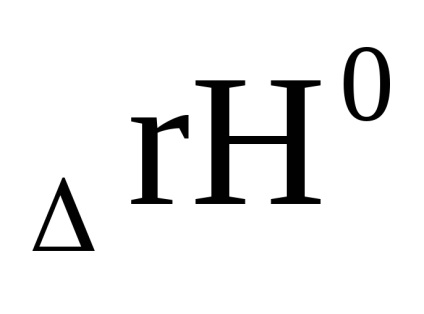
Якщо пряма реакція екзотермічна (