Звіт про лабораторну роботу 1
Студента гр. О-24
Неемпіричний Квантовохімічний розрахунок молекули CH4.
1. Мета та завдання РОЗРАХУНКУ.
Мета розрахунку: Визначення критеріїв вибору і вивчення принципів побудови стан-дартного базисного набору для розрахунку молекулярних систем. Вивчення методів інтерпретації результатів розрахунку та подання молекули у вигляді вектора властивостей на їх основі. Знайомство з програмним комплексом GAMESS.
Завдання розрахунку: Вибрати найменший з можливих оптимальний базис для неемпіричних розрахунку довжин зв'язків і валентних кутів молекули CH4 з по програмному комплексу GAMESS з точністю порядку 0.01 А для довжин зв'язків і 1 градус для валентних кутів, порівнянної з експериментальною. На підставі результатів розрахунку оцінити стабільність і фактори, визна-ділячи реакційну здатність цієї молекули.
2. ХАРАКТЕРИСТИКА І ОБГРУНТУВАННЯ МЕТОДУ РОЗРАХУНКУ.
Розрахунок молекули CH4 здійснений по програмному комплексу GAMESS в стандартному базисному наборі поплив 6-31G *. Цей базис є валентно-розщепленим. Валентні МО представлені лінійними комбінаціями 2 стислих комбінацій гауссових орбіталей, остовне МО - 1-й. На кожному неводородном атомі також центрировано по 6 компонент поляризаційних d-функцій. Таким чином, базис для розрахунку молекулиCH4 складається з 23 функцій:
1 * C (1 (1s) + 2 * 4 (2s + 2p) + 6 (3d)) +
4 * H (2 (1s) = 23
Всі валентні базисні функції двухекспоненціальние (6-31 G *), остовне 1s МО - одноекспоненціальни. s- і p-стиснення, відповідні (з формальної точки зору) одному головному квантовому числу n, згорнуті в sp-оболонки [(2s + 2p), (3s + 3p)] і представлені різними лінійними комбінаціями гауссових примітивів з однаковими експонеціальнимі множителями.
Кожна експонента остовного стиснення представлена лінійною комбінацією з 6 гауссових примітивів (6 -31G *). Кожна експонента стиснення для валентних електронів представлена лінійною комбінацією або з 3 (6-3 1G *), або з 1 (6-31 G *) гауссових примітивів.
Базис 6-31G * є найменшим з можливих базисів для розрахунку довжин зв'язків і валентних кутів молекули CH4 з експериментальної точністю. Додавання поляризаційних d-функцій (6-31G *) враховує поляризацію «пухких» електронних оболонок атомів галогенів при утворенні зв'язків (забезпечує зменшення довжини зв'язків
3. ІНТЕРПРЕТАЦІЯ РЕЗУЛЬТАТІВ РОЗРАХУНКУ.
1. Оцінка стабільності молекули.
Ентальпія утворення молекули CH4 з простих речовин дорівнює:
f H 0 (CH4) = E (CH4) - 1 / 2E (C2) - 2E (H2) = -40.19517 + ½ * 75.37903 + 2 * 1.12683 = -0,25184 а.о. = --158,032 ккал / моль -661,205 кДж / моль
Висновок: Молекула CH4 стабільна в стандартних умовах.
2. Властивості зв'язків молекули CH4
Уточнена геометрія і порядки зв'язків молекули CH4:
4.Визначення нуклеофільних і електрофільних властивостей молекули CH4.
Енергія НВМО молекули CH4 позитивна (0.2571 а.о.).
Висновок. Молекула CH4 нуклеофил.
5. Визначення жорсткості і м'якості молекули.
ВЗМО молекули CH4 тричі виродилися. Різниця її енергії і енергії більш низьколежачих МО невелика (0,3984 а.о.).
Висновок. Молекула CH4 являетсяжесткім реагентом.
Жорсткість молекули CH4:
=
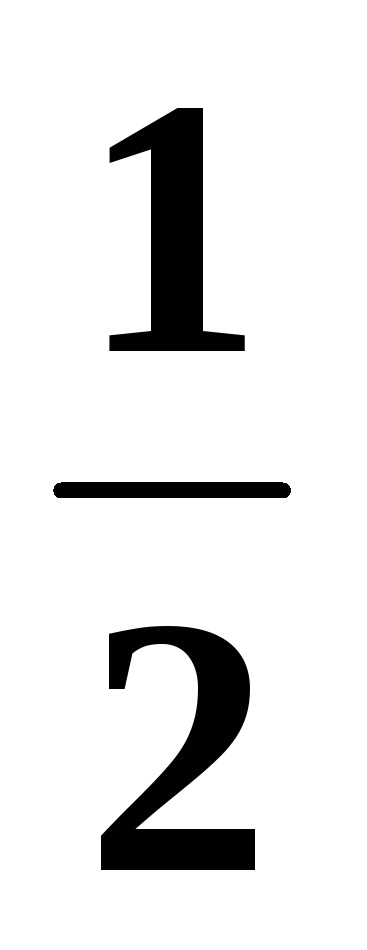
М'якість молекули CH4:
6. Позиціонування реакційних центрів.
Реакційна здатність молекули CH4 як жорсткого реагенту визначається зарядами на ато-мах. Розподіл зарядів на атомах по Маллікену наступне:
Максимальний негативний заряд на атомі C.
Висновок. Атоми С - найбільш ймовірні центри електрофільної атаки.
7. Оцінка розчинності.
Електричний дипольний момент молекули CH4 має невелику величину 0.00 D.
Висновок: Молекула CH4 розчинна переважно в неполярних розчинниках.