Склад ядра. Експериментально встановлено, що атомне ядро складається з протонів і нейтронів. Ці частинки називають нуклонами.
Протон (р) має позитивним зарядом е і масою
де mе - маса електрона, а.е.м. - атомна одиниця маси. Значення маси протона наведено в енергетичн-ських одиницях як прийнято в ядерній фізиці.
Протон має спін s = 1/2 і власний магнітний момент
де MЯ - ядерний магнетон (одиниця, в якій вимірюють маг-нітних моменти нуклонів):
Ядерний магнетон в 1836 разів менше магнетона Бора, т. Е. Соб-жавного магнітний момент протона в 660 разів менше магніт-ного моменту електрона.
Нейтрон (n). Його електричний заряд дорівнює нулю, а маса близька до маси протона:
що на 0,14% або 2,5 mе більше маси протона.
Атомна одиниця маси дорівнює 1/12 маси нейтрального атома 12С, т. Е. 1 а.е.м. = 1,66 · 10 -24 г або 931,50 МеВ.
Спін нейтрона s = 1/2 і, незважаючи на відсутність електричні-ського заряду, нейтрон має магнітний момент
Знак мінус означає, що «напряму» спина і магнітного моменту у нейтрона взаємно протилежні.
У вільному стані нейтрон нестабільний і самопроізво-льно розпадається, перетворюючись на протон і випускаючи електрон і ще одну частинку, нейтрино (v):
Період напіврозпаду (час, за який розпадається половина початкового кількості нейтронів) дорівнює приблизно 12 хв.
Характеристики атомного ядра. Основними величинами, ха-рактерізует атомне ядро, є Зарядове Z і масо-ше А числа. Число Z дорівнює кількості протонів в ядрі і визна-чає його електричний заряд Ze. Його також називають атом-ним номером. Масове число А визначає число нуклонів в ядрі. Число нейтронів в ядрі
Символічно ці характеристики ядра позначають так:
де під X мається на увазі хімічний символ елементу, которо-му належить дане ядро, наприклад, Н, Hе, U і т. д.
Конкретні атоми з даним числом протонів і нейтронів в ядрі прийнято називати нуклідами. Нукліди з однаковим числом протонів (т. Е. Належать одному хімічному елементу) називаючи-ють ізотопами.
Атоми ізотопів мають практично дуже близькими фі-Зіко-хімічними властивостями. Це пов'язано з тим, що на ладі-ня електронної оболонки атома ядро впливає в основному тільки своїм електричним полем. У ізотопів ці поля одина-підступи, за винятком деяких випадків. Найсильніше ця різниця у трьох нуклідів: Н, Н і H, ядра яких також істотно відрізняються один від одного. Тому цим трьом нуклідів присвоєні різні назви - відповідно зви-ний водень, дейтерій і тритій. а ядра дейтерію і тритію - дейтрон (d) і тритон (t).
У різних атомів число ізотопів різному, серед них име-ються стабільні і радіоактивні.
Розміри ядер. У атомного ядра (як і у будь-якої квантової системи) немає чітко визначеної межі. В експериментах з розсіювання електронів і нуклонів на ядрах встановлено, що в кожному ядрі є внутрішня об-ласть, в якій щільність # 961; ядерного речовини практично постійна, і
поверхневий шар, де ця пліт-ність падає до нуля. Типове рас-пределеніе концентрації нуклонів в залежності від відстані до центру
ядра, т. е. п (г) показано на малюнку
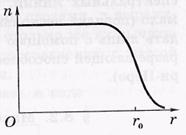
де rо - радіус ядра - відстань від центру ядра, на якому концентрації-ція нуклонів падає в два рази.
У першому наближенні ядро можна вважати сферичним радіусу
де 1 фм = 10 -13 см. З цієї формули випливає важливий висновок: маса ядра, що визначається масовим числом А. пропорциональ-на його обсягу V. оскільки V
А. Отже, пліт-ність речовини у всіх ядрах приблизно однакова і, як поки-показують розрахунок, дорівнює # 961; 2 · 1014 г / см 3.
Маса і енергія зв'язку ядра
Маса ядра не є адитивною величиною: вона не дорівнює сумі мас утворюють ядро нуклонів. Причиною є сі-льно взаємодія нуклонів в ядрі. Через це взаємодій-наслідком для повного поділу ядра на окремі вільні нуклони необхідно провести мінімальну роботу, яка і визначає енергію зв'язку ядра Есв. Навпаки, при освітньої-ванні ядра з вільних нуклонів ця енергія виділяється (у вигляді, наприклад, електромагнітного випромінювання).
Для спрощення розрахунків вводять поняття дефект маси як різниця між масою (в а.е.м.) і масовим чис-лом А ядра або нуклона: = m-А.
де N = А-Z. Відповідно і в таблицях можуть призвести не маси нуклідів, а їх дефекти мас.
Питома енергія зв'язку. Так називають енергію зв'язку, при-ходячи в середньому на один нуклон, тобто Есв / А. Ця величина характеризує міру міцності ядра: чим більше Есв / А. тим ядро міцніше.
Енергія зв'язку електронів в атомах близько 10 еВ, що дуже малий з величиною уде-льно енергії зв'язку ядра.
Питома енергії зв'язку Есв / А за-висить від масового числа А. Графік відповідної зависи-мости показаний на малюнку.
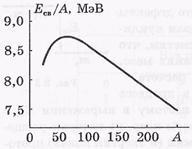
Питома енергія зв'язку ядер майже не залежить від
масового числа А і дорівнює при-мірно 8 МеВ. Наближена НЕ-залежність питомої енергії зв'язку від А означає, що ядерні сили мають властивість наси-щення. Воно полягає в тому, що кожен нуклон взаємо-діє тільки з обмеженим чис-лом сусідніх нуклонів.
Звідси також випливає, що ядерні сили є коротко-діючими з радіусом порядку середньої відстані між нуклонами в ядрі (
Найбільш міцними є ядра з масовими числами А
50 ÷ 60, т. Е. Елементів від Сг до Zn.