Загальні відомості про аміаку
Аміак є безбарвний газ, який при кімнатній температурі і під надлишковим тиском зріджується.
Рідкий аміак - це безбарвна рідина, твердий - речовина білого кольору. Щільність - 0,7708л. Температура плавлення - (-77,75 o C), кипіння - (-33,4 o C). Брутто-формула - NH3 (будова молекули показано на рис. 1). Молярна маса аміаку дорівнює 17,03 г / моль.
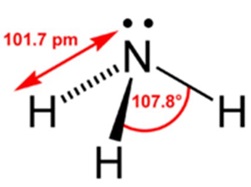
Мал. 1. Будова молекула аміаку із зазначенням валентного кута і довжини хімічного зв'язку.
Добре розчиняється у воді, утворює гідрат складу NH3 × H2 O, розчин якого має слаболужну середу. Розведений розчин аміаку (3-10%) називають нашатирним спиртом, концентровані розчини (18,5 - 25%) - аміачною водою.
Вельми реакционноспособен, схильний до реакцій приєднання. Згорає в кисні, реагує з кислотами, металами, галогенами, оксидами і галогенидами. Якісна реакція - почорніння папірці, змоченою розчином Hg2 (NO3) 2 (освіта ртуті).
Рідкий аміак - основний протонний розчинник; добре розчиняє сірку, нітрати (крім фторидів) і нітрати лужних металів, галогеніди амонію і т.д.
Аміак, ступеня окислення елементів в ньому
Аміак - це гідрид азоту, а, як відомо, водень в гідридах неметалів завжди проявляє ступінь окислення дорівнює (+1). Для знаходження ступеня окислення азоту приймемо її значення за «х» і визначимо його за допомогою рівняння електронейтральності:
Ступінь окислення азоту в аміаку дорівнює (-3):