Мал. 9.7. Схеми расклинивающего (отталкі-вающего) дії однойменно заряджених іонів. розташованих на поверхні газо-вих пухирців аа і bb \ (I), і ефекту Мерен-гони в поверхневих шарах ab і а'Ь ', охоплення-вающих газові бульбашки (заштрихована частина - рідина) (II)
В. Я. Явойський виділив дотримуюся-щие фактори, що визначають схил-ність шлаку до вспениванию:
1. Поверхнева в'язкість шлаку, т. Е. Механічна міцність поверх-ностной плівки, яка визначається, в свою чергу, концентрацією поверх-ностно-активних великих аніонів (кремнекислородних або кремнефосфорістих комплексів).
2. Гетерогенність шлаків, присут-ність в них добре змочуваних йшла-ком (ліофільних) твердих частинок.
4. Температура шлаку (низька тим-пература визначає підвищені ме-ханических міцність плівки, поверх-ностно в'язкість шлаку і уповільнений-ний характер розчинення зважений-них в шлаку твердих частинок).
5. Інтенсивність і характер газо-вого потоку, що пронизує шар шлаку (збільшення інтенсивності га-зовиделенія, а головне - ступеня дисперсності газових бульбашок, обра-зующих потік, що пронизує йшла-ковий розплав, призводить до зростання піноутворюваність шлаку).
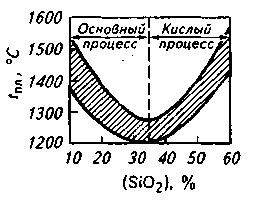
6. Хімічний склад шлаку. В ос-новних шлаках схильність до пенооб-разованию підвищується при вище-ванні концентрації SiO2 і Р2 ПРО5 і по-ніженіе істинної основності (т. Е. Основності, розрахованої за концентрацією розчиненого оксиду каль-ція). Присадка плавиковогошпату в рухомих шлаках кілька підвищена-шает схильність шлаків до вспениванию в зв'язку з підвищенням в шлаку концентрації поверхнево-актив-ного іона F -. Підвищення концентрації-ції оксидів заліза збільшує схильність шлаків до вспениванию в результаті стимулюючої дії на розвиток подшлакового процесу окислення вуглецю, сопровождающе-гося утворенням безлічі дрібних бульбашок, повільно спливаючих в шлаку.
7. Тиск газового середовища над шаром шлаку (підвищення тиску в плавильному просторі печі, нали-чие настильній пружною струменя Пекаха-ла, осаджують піну, призводять до зменшення ціноутворення).
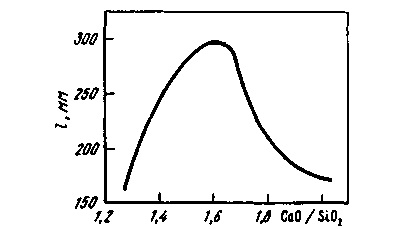
Найбільшою схильністю до спінен-Нівань мають шлаки з основнос-ма 1,5-1,6 (рис. 9.8). Підвищення в шлаку змісту оксидів заліза і марганцю сприяє зниженню схильності шлаків до вспениванию. Всі заходи щодо прискорення йшла-кообразованія для отримання по рас-плавленні більш сприятливою і більш високою основності сприяють зменшенню піноутворюваність шлаків. До них відносяться різні прийоми інтенсивного перемішування ванни, методи прискореного нагріву, способи заміни звичайних шлакообразующих (вапняку, залізної руди) комплекс-ними, заздалегідь підготовленими флюсами (продукти, наприклад, со-вместно випалу вапняку, залізної і марганцевої руд та ін. ), викорис-тання шлакообразующих в порошку-кообразном вигляді і т. д.
Технологія ведення плавки стали в сучасних високопотужних дугових електропечах включає операцію штучного спінювання шлаку. Для цього на шлак або під шлак вводять (частіше вдувають) порошок коксу або кам'яного вугілля, ініціюючи протека-ня реакції окислення вуглецю-посередньо в шлаку. Утворюють-ся дрібні бульбашки СО забезпечують інтенсивне спінювання шлаку; со-відповідально створюються благоприят-ні умови для екранування дуг, зменшення опромінення стін і склепіння печі і поліпшення засвоєння тепла ван-ної.
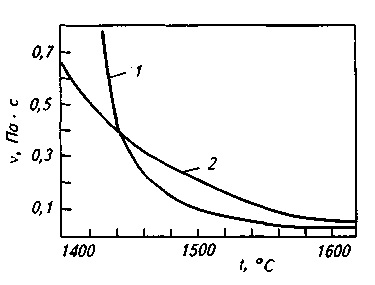
В'язкість рідких сталеплавильних шлаків коливається в широких преде-лах, причому характер зміни в'яз-кості від температури залежить від зі става шлаку. З рис. 9.10 видно, що, в той час як в'язкість кислих шлаків в міру зміни температури вимірюв-вується плавно ( «довгі» шлаки), ос-новні шлаки мають короткий тим-температурних інтервал переходу з рідкого в твердий стан ( «корот-кі» шлаки ); в'язкість таких шлаків зазвичай різко зростає при знижені-ванні температури нижче 1500 ° С.
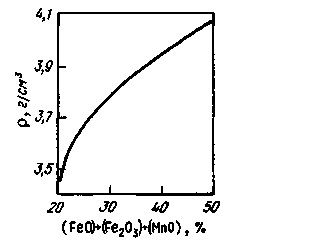
Мал. 9.9. Залежність щільності основних
шлаків від змісту оксидів заліза і марганцю
Теплоємність шлаків в завісімос-ти від складу і температури змінює-ся в досить вузьких межах: 0,8 1,2кДж / (кг * К).
Рідкі шлаки мають електрич-чеський провідністю, що є показником їх іонного будови. Електрична провідність основ-них шлаків вище, ніж кислих. При підвищенні температури електричні-кая провідність збільшується. При температурах сталеплавильних про-процесів електрична провідність шлаків в залежності від їх складу коливається в межах від 0,2 до 1,0 Ом -1 • см -1. Дані про електричні-кою провідності шлаків необхід-ми при організації процесів елект-роплавкі, електропідігріву шлаку в ковші при позапічної обробці ме-Таллі, при електрошлаковій переплив-ве і т. П. Електрична провідність зазвичай вище у шлаків, що володіють підвищеною теплопровідністю і зниженою в'язкістю. Теплопровід-ність шлаків змінюється в завісімос-ти від складу в широких межах; при підвищенні температури ТЕПЛОПРОМ-водність зростає. Реальні шлаки являють собою многокомпонентен-ні системи, тому складно визна-лити їх температуру плавлення, знаючи температури плавлення складових цих шлаків. Зазвичай використовують дан-ні потрійних діаграм стану шлакових систем. що дозволяють при-наближенні судити про температурах плав-лення реальних шлаків більш складно-го складу. З діаграми стану СаО-А12 О3 (рис. 9.11) випливає, що при введенні в основний шлак А12 О3 (в боксі багато А12 О3)
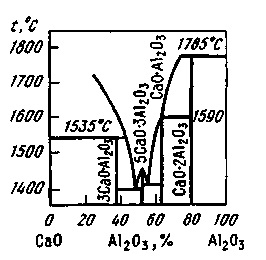
Мал. 9.11. Діаграма стану СаО-А12 О3
10. БУДОВА РІДКОЇ СТАЛИ
10.1. ЗАГАЛЬНІ ВІДОМОСТІ
Рідкий стан речовини вважається проміжним між твердим і га-зообразним. І якщо ідеальний газ ха-рактерізует повним разупорядоче-ням будови, а ідеальне тверде тіло (кристал) - повним впорядкували-ням в розташуванні частинок і нез-менность цього розташування в про-просторі і часі, то для рідини такої ідеальної моделі поки немає. Через Вестн англійський фізик Дж. Бернал запропонував класифікувати з-стояння матерії в такий спосіб: кристали володіють регулярною і пов'язаної структурою, рідини - нерегулярної і пов'язаної структурою, гази - нерегулярної і незв'язаної структурою. Структура рідини отли-чає від структури кристала і газу. Крім того, кожна рідина має ряд структур, які можуть вільно переходити одна в іншу.
Розплавлені метали мають комплекс властивостей, з одного сторо-ни, подібних зі властивостями неметал-вих рідин, а з іншого - з властивостями твердих металів. Харак-терни відмітними ознаками металевих рідин (розплавів) від усіх інших рідин являють-ся: високі електричні та Гальве-номагнітние властивості (електрична провідність, т. Е. Д. С. Ефект Хол-ла, обумовлені наявністю колектив-тівізірованних валентних електро- нов), висока щільність в размеще-ванні частинок (іонів); при цьому питома-ний обсяг металевої рідини в точці плавлення не перевищує питома-ний обсяг кристала більш ніж на 2 6%, т. е. при плавленні кристала відстані між складовими його частками змінюються незначи-кові.
Залізо є Зd -переходним металом. Конфігурація зовнішніх електронних оболонок в твердому ж-лезе 3p63d64s2. Радіус атома заліза 0,128нм. Кристалічна залізо в залежності від температури і тиску-ня може перебувати в декількох модифікаціях ().
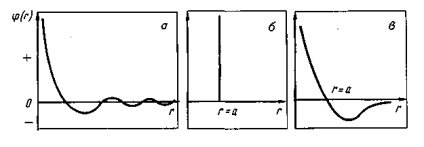
При розгляді заліза і його сплавів слід враховувати властивий-ні сталеплавильним процес не-великі перегріви металу відноси-кові температури плавлення. Якщо температура плавлення сталі в зави-ності від її складу зазвичай колеб-лется в межах від 1450 до 1535 ° С, то температура рідкого сталевого розплаву в сталеплавильному агрега-ті складає 1500-1650 ° С. Напри-заходів, температура плавлення сталі -1500 ° С, а температура рідкого рас-плаву в пені -1600 ºС, т. Е. Ступінь пе-регрева а взаємодія між частини-цями відсутня (частки не отталкі-ються і не притягуються) і (r) = 0.
У статистичної теорії рідини використовується також функція радіального розподілу. Фізичний зміст цього поняття може бути пояснений наступним чином. Для одноатом-ної рідини, що не піддається зовн-ним дій і володіє оди-наково в усіх напрямках свій ствами (ізотропної), всі положення будь-якої її частки різновірогідні. У такій рідини розподіл часток щодо будь-якої довільно обраної частки сферично сім-симетрично, а величина g, що характеризують-ющая інтенсивність взаємодії часток, визначається тільки расстоя-ням r між частками. Функцію g (r) називають радіальної функцією атомного розподілу (або просто функцією радіального розподілу) і визначають експериментально мето-дами рентгене-, електроне- і нейтро-монографій. Величина g (r) характеризу-ет зміна ймовірності виявили-ня будь-якої частки в сферичні-ком шарі на відстані г від частки, обраної за початок координат (в об-ласті поблизу початку координат веро-ятность знаходження іншої частинки дорівнює нулю). На певному рас-стоянні від початку координат (зазвичай рівному декільком діаметрам частини-ці) все взаємні розташування годину-тиц різновірогідні, т. Е. Має місце дальній порядок. Коливання значень функції g (r) поблизу початку координат свідчать про наявність ближнього порядку. Якщо ізвестни- потенціал межчастичного взаємодії (r). і функція радіального розподілу g (r), то можна розрахувати багато рав-новесние властивості рідини.
Моделі будови рідкого металу. В даний час існує біль-ШОЕ число модельних теорій будови рідини.
Мал. 10.1. Схематичний вигляд ефективних парних потенціалів взаємодії
У 1924 р радянський вчений Я. І. Френкель один з перших. хто про-ратіл увагу на те, що рідкі ме-Таллі при температурах, близьких до температури плавлення, за багатьма ха-рактеристики незначно відрізняючи-ються від кристалічних тіл. При цьому вільний об'єм рідини, що дорівнює надлишку обсягу в порівнянні з обсягів по-мом відповідного твердого тіла при абсолютному нулі, представлений окремими мікрополем, Вакан-тнимі вузлами або «дірками». Мо-дель отримала назву діркова. Відповідно до цієї моделі через наявність дірок ступінь порядку в розташуванні атомів в рідині менше, ніж у кристала. Наявністю дірок пояснюються великі теку-честь, стисливість, термічне розширення і коефіцієнти Діффі-зії у рідини. Впорядковане рас-положення атомів є тільки поблизу кожної частки (ближній по-рядок). В рамках доречний теорії теплове рух в рідині має такий же характер, як і в твердих ті-лах, т. Е. Зводиться в основному до гармо-ническим коливань частинок близько деякого середнього положення. Че-рез якийсь (як завгодно мале) час частка може зайняти нове по-ложення, перескочивши на відстань, близьке до міжатомній.
У 1927 р Стюарт і Морроу розроб-бота модель будови рідини, ос-Нова на уявленні про те, що при плавленні межмолекулярное вза-імодействіе певною мірою зберігається (принаймні, аж до досягнення певної крити-чеський ступені перегріву). При цьому допускається, що впорядковане раз-ня частинок в рідини не огра-нічівается безпосередньо сусідніх-ми частинками, а простягається на великі обсяги. комплекси або групи (так званий дальній по-рядок взаємного розташування годину-тиц). Ці групи спочатку були назва-ни сіботаксісамі '. Сіботаксіси не мають різко окреслених меж; пре-майнова орієнтація молекул або атомів в серцевині безперервно змінюється безладним расположе-ням частинок в розділяє сіботак 1 Ковчег (грец.). сіси обсязі; сіботаксіси непрерив-но зароджуються і руйнуються.
В останні роки в технічній літературі замість терміна «сіботак-сис» часто стали застосовувати «кластер» 2 (використовують також терміни «мікро-угруповання», «угруповання», «рій», «комплекс» і ін.). Прийнято вважати, що кластер (або сіботаксіс, рій і т. П.) Не може бути кваліфікований як представник іншої фази; він не має фізичної кордону розділу, при переході через яку парамет-ри стану і властивості змінювалися б стрибкоподібно, і в той же час він характеризує структуру самої рідко-сти. Теорія рідкого стану до цих пір знаходиться в стадії розробки, так як не ясні питання, пов'язані з визначенням тривалості життя кластерів, частотою їх зарож-дення і розпаду, з визначенням соот-носіння обсягів, займаних клас-терамі і разупорядоченной зоною, з визначенням ступеня перегріву, тим-ператури, при якій настає пів-ве розупорядкування розплаву. По не-яким даними, повне разупорядо-чення настає при дуже високих перегревах (800-900 ° С) над лінією ліквідусу.
Є й інші моделі рідко-стей. Слід відзначити внесок в дослі-дованіе- рідкого стану стали ряду російських вчених: В. І. Дані-лову, Я. І. Френкеля, Н. А. Вато-лина, В. І. Явойського, П. В. Гельда, С . І. Попеля, Б. А. Баума, А. М. Сама-рина, А. А. Вертман, П. П. Арсентьева, В. А. Григоряна, Г. Н. Єланського і ін.