Вірусні вектори [ред]
Завдяки особливостям життєвого циклу вірусів, перші вектори (носії трансгенів) для генотерапіі стали розробляти саме на їх основі. Віруси переносять чужорідні гени, які потім здатні експресувати в заражених клітинах. Спрощено вірус можна уявити як нуклеїнових кислот, упаковану в оболонку. Вірус проникає в клітину-мішень, де відбувається експресія вірусного генома. Для створення гарного вектора необхідно змінити деякі властивості вірусу. У більшості випадків вірус повинен бути позбавлений можливості до репродукції, щоб запобігти неконтрольоване поширення трансгени. Крім того, частина вірусного генома необхідно видалити, щоб звільнити місце для чужорідного генетичного матеріалу. Інші необхідні зміни залежать від типу вірусу. Вірусні вектори широко використовують в доклінічних дослідженнях і в даний час саме з ними проводять більшість клінічних випробувань.
Ретровіруси [ред]
Це невеликі РНК-віруси, здатні заражати лише діляться клітини, в яких вони репродукуються. Вірусний геном (у вигляді провируса) вбудовується в ДНК клітини-мішені. Тому ретровірусних вектори теоретично здатні забезпечити тривалу експресію трансгенів в деяких типах клітин. Більшість ретровірусних векторів отримано на основі вірусу лейкозу мишей Молоні. Геном вірусу змінений так, щоб уникнути експресії вірусних білків в заражених клітинах, що запобігає розвитку імунної відповіді проти цих клітин. Оскільки ці віруси заражають тільки діляться клітини, ретровірусних вектори використовують в основному для трансдукції клітин ex vivo (див. Нижче) або для експериментального лікування злоякісних новоутворень.
Життєвий цикл. Геном ретровірусів складається з плюс-ланцюга РНК. Оболонка ретровірусів утворюється з мембрани зараженої клітини і містить вірусні білки. Для реплікації генома і збірки вірусів необхідні три вірусних гена - gag, pol і env. У зараженій клітині шляхом зворотної транскрипції на матриці вірусної РНК відбувається утворення дволанцюгової ДНК (провируса), яка потім вбудовується в клітинний геном. Це забезпечують вірусні білки - зворотна транскриптаза і інтеграли. Для проникнення провируса в ядро необхідно руйнування ядерної оболонки клітини, що відбувається в ході мітозу. Вбудувати в клітинний геном провірус використовує апарат клітини для транскрипції віруснихмРНК, їх процесингу і трансляції. Життєвий цикл вірусу завершується з синтезом нових плюс-ланцюгів РНК на матриці провируса. Специфічна послідовність в молекулі РНК (psi) дає сигнал збірки, після чого нові віруси відокремлюються від поверхні клітини.
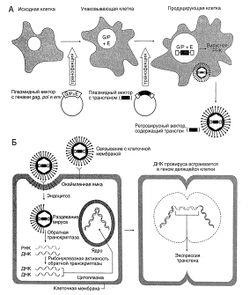
Малюнок 5.1. Використання ретровирусного вектора. А. Схема отримання ретровирусного вектора.
Конструкція і отримання вектора. Ретровірусних вектори отримують з відповідного провируса. Гени gag, pol і env видаляють, щоб звільнити місце для нового генетичного матеріалу і запобігти репродукцію вірусу (рис. 5.1). У ретровірусний вектор може бути включено до 8000 пар нуклеотидів чужорідної ДНК. Оскільки рекомбінантний вірус не може синтезувати вірусні мРНК, то в трансфікованих клітинах відсутній і синтез вірусних білків, які могли б викликати імунну відповідь. Разом з геном, призначеним для лікування, в вектор можна ввести промотор і енхан-сер, що забезпечують ефективну експресію трансгена і, в ряді випадків, її тканеспеціфічность. Можна використовувати також вірусні промотор і енхансер, розташовані в області довгих кінцевих повторів (LTR).
Опис до рисунок 5.1. Використання ретровирусного вектора. А. Схема отримання ретровирусного вектора. Для отримання нездатних до репродукції ретровірусних векторів використовують спеціальні лінії клітин, здатні синтезувати ті вірусні білки, гени яких видалені при конструюванні вектора. В клітини підходящої лінії (наприклад, ембріональні клітини нирки людини) за допомогою бактеріальних плазмід вводять гени gag (G), pol (Р) і env (Е). Клітини, які синтезують відповідні вірусні білки, називають упаковують. Потім плазмиду, що містить рекомбінантний ДНК провируса, в якій замість генів gag, pol і env знаходиться потрібний трансгени, використовують для трансдукції пакувальних клітин. Тепер клітини містять все, що потрібно для складання вірусів, і ретровірусних вектори починають накопичуватися в культуральному середовищі. Ці вектори містять трансгени, але позбавлені вірусних генів gag, pol і env, а тому при зараженні наступної клітини вони не можуть репродукуватися. Б. Експресія трансгена в клітці-мішені після впровадження РНК-яке містить ретровирусного вектора (див. «Життєвий цикл»).
Безпека. Оскільки вірус вбудовується в клітинний геном (що важливо для тривалої експресії), причому випадковим чином, існує ризик виникнення мутації (інсер-ційний мутагенезу). Наприклад, вбудовування вірусу може змінити функцію гена, що регулює поділ клітин, що призведе до небажаних наслідків. Здатні до репродукції ретровіруси мають деякою канцерогенність, однак цього не спостерігається у ретровірусних векторів, позбавлених такої здатності.
Лентивіруси [ред]
Застосування лентівірусних векторів майже не викликає запалення або інших ознак ураження тканин.
Аденовіруси [ред]
Аденовірусні вектори забезпечують ефективну трансдукцію як діляться, так і не діляться клітин з наступною експресією трансгенів. Можна використовувати різні шляхи введення, наприклад в / в, внутрішньочеревно, внутріпузирного, внутрішньочерепної, інтратекальний, а також ін'єкцію в жовчні шляхи або безпосередньо в паренхіму органу. Різноманіття шляхів введення дозволяє вибрати найкращий для обраної мішені. Аденовірусні вектори мають два суттєвих недоліки. По-перше, після зараження клітини вірусний геном не вбудовується в ДНК клітини, тому тривалої експресії трансгена не відбувається. По-друге, аденовірусна інфекція активує як клітинне, так і гуморальну ланки імунітету, що веде до знищення трансфікованих клітин і знижує ефективність повторного введення вектора. Побічні ефекти аденовірусних векторів також пояснюються імунною відповіддю.
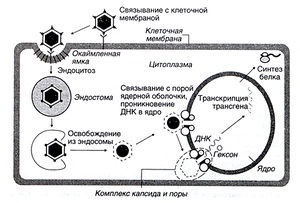
Малюнок 5.2. Використання аденовірусного вектора.
Оскільки гени Е1 беруть участь в репродукції аденовірусів, їх видалення блокує або, принаймні, істотно ускладнює репродукцію. Через більш складної будови вірусу видалити з вектора все аденовірусні гени важче, ніж ретровірусних. Синтез аденовірусних білків після зараження клітин існуючими аденовірусні векторами активує клітинне і гуморальну ланки імунітету. У деяких випадках це може обмежувати використання вектора внаслідок загибелі трансфікованих клітин і низьку ефективність повторного введення вектора.
Опис до рисунок 5.2. Використання аденовірусного вектора. Рекомбінантний аденовірус зв'язується зі специфічними рецепторами на поверхні клітини-мішені і проникає в неї шляхом ендоцитозу. Вірусні білки забезпечують вихід вірусу з ендосоми до її злиття з лизосомой; завдяки цьому вірус уникає руйнування. Аденовірусна ДНК звільняється від білків і проникає в ядро, де починається синтез нових мРНК. При цьому аденовірусна ДНК, що містить трансгени, не вбудовується в геном клітини-господаря.
Аденовірусні вектори у великій кількості отримують шляхом зараження пакувальних клітин (зазвичай ембріональних клітин нирки людини, лінії 293), що експресують вірусний білок Е1, що компенсує відсутність відповідного гена в рекомбінантному вірус. Потім заражені клітини лизируют, а лизат піддають центрифугированию в градієнті щільності хлориду цезію. Цей метод дозволяє не тільки очистити віруси від інших компонентів клітинної культури, а й сконцентрувати його, отримавши більше 10 ^ 13 вірусів в 1 мл. Очищений вірус дуже стійкий в різних буферних розчинах, а для тривалого зберігання може бути заморожений без втрати активності.
Застосування. В даний час проводиться багато клінічних випробувань, в яких аденовірусні вектори застосовують для лікування як спадкових, так і набутих захворювань. При лікуванні спадкових захворювань великим недоліком є нетривалість експресії трансгенів і імунну відповідь на заражені клітини. Позахромосомна локалізація аденовірусного генома в клітині обмежує тривалість експресії трансгенів в активно діляться клітинах (наприклад, клітинах кісткового мозку або епітелію), так як поділ клітин не супроводжується реплікацією трансгени. Аденовірусні вектори, як здатні, так і не здатні до репродукції, можуть знайти застосування в лікуванні злоякісних новоутворень (див. Нижче).
Застосування. Аденоассоціірованних вектори почали застосовувати в клініці: зараз проводяться клінічні випробування доставки генів в легені і в скелетні м'язи. Мабуть, ці вектори підходять для забезпечення тривалої експресії трансгенів в скелетних м'язах, серце, ЦНС і інших тканинах. Перші результати клінічного випробування, в якому за допомогою аденоасоційованого вектора здійснювали доставку гена фактора IX в скелетні м'язи хворих на гемофілію, виявилися успішними (див. Нижче). Здатність цих векторів забезпечувати тривалу експресію трансгенів, не надаючи токсичної дії на клітини і не викликаючи імунної відповіді, робить їх перспективним інструментом лікування деяких спадкових захворювань.