Хімічним еквівалентом називається таке його кількість, яке з'єднується з 1 молем атомів водню або заміщує ту ж кількість атомів водню в хімічних реакціях. Наприклад, в НСl, Н2 S, NH3. СН4 еквівалент хлору, сірки, азоту, вуглецю дорівнює відповідно 1 молю, 1/2 благаючи, 1/3 благаючи, 1/4 благаючи.
Еквівалентна маса - це маса 1 еквівалента речовини (г / моль). У наведених вище прикладах еквівалентні маси хлору, сірки, азоту та вуглецю відповідно рівні 35,45 г / моль, 32/2 = 16 г / моль, 14/3 = 4,67 г / моль, 12/4 = 3 г / моль .
Значення еквівалентної маси елемента визначається з рівняння:
Е - еквівалентна маса елемента;
А - атомна маса елемента;
В - валентність елемента в даному з'єднанні.
Наприклад, ЕAl в Аl2 О3 дорівнює 27/3 = 9 г / моль; ЕCa в СаSO4 дорівнює 40,08 / 2 = 20,04 г / моль.
З рівняння (1) випливає, що на відміну від атомної або молярної маси маса не є постійною величиною, а залежить від валентності елемента. Постійні значення еквівалентних мас можуть бути тільки у елементів з постійною валентністю.
Поняття про еквівалентних масах і еквівалентах поширюється і на складні речовини.
Еквівалентом складного речовини називається таке його кількість, яке взаємодіє без залишку з одним еквівалентом водню або з одним еквівалентом будь-якого іншого речовини.
Еквівалентну масу речовини обчислюють з його молярної маси:
М - молярна маса.
Основность кислоти визначається числом атомів водню, яке віддає молекула кислоти, реагуючи з підставою.
Кислотність підстави визначається числом протонів, приєднаних молекулою підстави при взаємодії його з кислотою.
Подібно еквівалентної масі елемента, еквівалентна маса складного речовини може мати кілька значень в залежності від реакції, в якій беруть участь речовини.
Наприклад, в реакції:
Еквівалентна маса кислоти дорівнює її мольной масі:
Маси взаємодіють один з одним речовин, пропорційні їх еквівалентним масам (еквівалентів):
mA і mB - маси взаємодіючих речовин А і В;
ЕA і ЕB - еквівалентні маси цих речовин.
Рівняння (2) - математичний вираз закону еквівалентів.
Метою роботи є визначення еквівалентної маси магнію. Дослід проводять на установці, схема якої представлена нижче на малюнку.
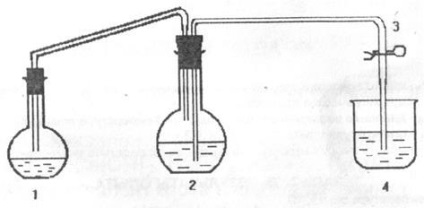
де, 1 - реакційна колба; 2 - кругла плоскодонна колба; 3 - затиск; 4 - стакан.
ПОРЯДОК ВИКОНАННЯ РОБОТИ
1. Зважити на технічних вагах близько 0,1 м магнію з точністю до 0,01 г.
2. Зібрати установку посхеме.
3. Налити в колбу (1) приблизно 25-30 мл. розведеної сірчаної кислоти. Протерти насухо внутрішню стінку горла колби 1 фільтрувальної папером.
4. Наповнити колбу (2) на 3/4 об'єму водою і закрити її пробкою з відвідними трубками. Вдмухуванням повітря через коротку трубку заповнити водою довгу трубку і затиснути затиск (3). Переконатися, що затиск тримає.
5. Налити в стакан (4) 50 см 3 води і спустити в неї довгу відвідну трубку з колби (2).
6. Поставити колбу (1) в горизонтальне положення і висипати зважене кількість магнію на суху стінку шийки (метал не повинен потрапити в кислоту!).
7. Закрити колбу (1) пробкою з короткою відвідної трубкою ють колби (2). Закривати слід обережно і ретельно. Колбу треба тримати за горло, пробку слід закривати обережно і поступово, злегка її обертаючи. (Необхідно следітьза тим, щоб магній потрапив в КИСЛОТУ!).
8. Поставити колбу (1) у вертикальне положення, одночасно швидко відкрити затискач (3) і залишити його відкритим.
9. Спостерігати взаємодія магнію з кислотою і витіснення воднем води з колби (2) в стакан 4.
10. Коли весь магній прореагує з кислотою, затиснути затиск (3), вийняти відвідну трубку зі склянки (4) і виміряти обсяг води в склянці циліндром.
11. З отриманого обсягу відняти 50 см 3 (т. Е. Кількість води, яке було налито в стакан до досвіду).
12. Різниця буде дорівнює обсягу виділеного водню V1
1. Написати рівняння реакції взаємодії магнію з розбавленою сірчаною кислотою.
2.Прівесті знайдений обсяг водню (V1) до нормальних умов за формулою:
V0- обсяг водню при нормальних умовах, см 3;
Р - барометричний тиск, кПа;
Pв - тиск насиченої пари води при температурі досвіду, кПа;
Т1 - температура досвіду, К. Т1 = 273 + t.
3.Вичісліть масу витісненого водню, визначити еквівалентну масу магнію.
Температура досвіду, ° С -
Барометричний тиск, кПа -
Навішування магнію, г -
Тиск насиченої пари води, кПа -
Обсяг водню за умови досвіду, см 3 -
Маса водню, г -
Еквівалентна маса магнію, г / моль-
Тиск насиченої пари води при різній температурі
За обсягом, витісненому при нормальних умовах водню (V0), обчислюють масу обсягу. З огляду на, що маса водню 22,4 л при нормальних умовах (н.у.) важить 2 г, знаходять масу H2.
22,4 H2 важить - 2,0 м
За відомим масам витраченого магнію (mMg) і витісненого їм водню визначають еквівалентну масу магнію:
Отриманий результат порівнюють з еквівалентної масою, що обчислюється за формулою:
А - атомнаямасса металу; В - валентність металу.
3. Скільки оксиду виходить при окисленні 3 г металу, еквівалентна маса якого дорівнює 9г / моль.
4. Визначити еквівалентні маси кислот і підстав:
5. Який обсяг займуть при н.у. маси одного еквівалента кисню і водню.
6. Визначити еквівалент металу, якщо 0,046 г його витіснений з кислоти 62,35 мл Н2 при t = 17 ° С і тиску 1,017 * 10 5 Па. Тиск водяної пари при 17 ° С дорівнює 0.193 * 10 5 Па.
7. Обчислити: а) еквівалентну масу олова, якщо при нагріванні 0,92 г його в струмі кисню утворюється 1,17 г оксиду олова;
б) магнію, якщо при нагріванні в струмі кисню маса його збільшилася на 66,7%.
8. Обчислити еквівалент сірчаної кислоти в реакції з КОН:
9. Обчислити еквівалент Са (ОН) 2 і H3 PO4. розрахувати, скільки грамів Са (ОН) 2 буде потрібно для нейтралізації 150 г Н3 РО4
Лабораторна робота № 3